
题目列表(包括答案和解析)
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |


硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(配平)来制取单质I2。NaIO3来源于自然界的矿物。
① NaIO3 + NaHSO3— NaI + Na2SO4 + H2SO4 ② IO3-+I-+H+—I2+H2O
(1)配平上述反应
(2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
(3)25℃时,H2SO3  HSO3-
+ H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh=
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-
+ H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh=
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液, 的值
;加入少量水,水的电离程度将 。
的值
;加入少量水,水的电离程度将 。
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(配平)来制取单质I2。NaIO3来源于自然界的矿物。
① NaIO3 + NaHSO3— NaI + Na2SO4 + H2SO4 ② IO3-+I-+H+—I2+H2O
(1)配平上述反应
(2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
(3)25℃时,H2SO3 HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液, 的值 ;加入少量水,水的电离程度将 。
的值 ;加入少量水,水的电离程度将 。
 HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中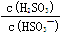 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,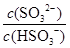 的值 ;加入少量水,水的电离程度将 。
的值 ;加入少量水,水的电离程度将 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com