(2011?宝鸡三模)[化学一选修2化学与技术]分析下面两个案例并回答有关问题.
(1)工业上生产硫酸时,利用催化氧化反应将SO
2转化为SO
3是一个关键步骤.压强及温度对SO
2转化率的影响如下表(原料气各成分的体积分数为:SO
2 7%,O
2 11%,N
282%):
压强/MPa
SO2转化率
温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2% |
99.6% |
99.7% |
99.9% |
|
500 |
93.5% |
96.9% |
97.8% |
99.3% |
|
600 |
73.7% |
85.8% |
89.5% |
96.4% |
①利用表中数据,如何推断出SO
2的催化氧化反应是一个放热反应?
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
②选择适应的催化剂,是否可以提高SO
2的转化率?
否
否
(填“是”或“否”)是否可以增大该反应所放出的热量?
否
否
(填“是”或“否”).
③已知:2SO
2(g)+O
2(g)
2SO
3(g),△H=-196.6k J/mol,计算每生产1万吨98%硫酸所需要SO
3质量为
8×103
8×103
t,由SO
2生产这些SO
3时放出的热量为
9.85×109
9.85×109
kJ.
(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe
2O
3,还含有SiO
2等杂质)、煤矿、石灰石和黏土,拟在该地区建设大型炼铁厂.
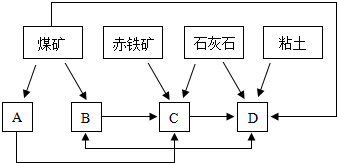
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系.据此确定上图中相应工厂的名称B
焦化厂
焦化厂
、D
水泥厂
水泥厂
.
②以赤铁矿为原料,写出高炉炼铁中得到生铁以及产生炉渣的化学方程式
Fe
2O
3+3CO
2Fe+3CO
2 、CaCO
3+SiO
2 CaSiO
3+CO
2 Fe
2O
3+3CO
2Fe+3CO
2 、CaCO
3+SiO
2 CaSiO
3+CO
2 .
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出1种措施即可)
用炼铁厂的炉渣(或CaSiO3)作为水泥厂的原料;或用发电厂的煤矸石和粉煤灰作为水泥厂的原料;或将石灰石煅烧成生石灰,用于吸收发电厂和焦化厂燃煤时产生的SO2,减少对空气的污染;或建立污水处理系统
用炼铁厂的炉渣(或CaSiO3)作为水泥厂的原料;或用发电厂的煤矸石和粉煤灰作为水泥厂的原料;或将石灰石煅烧成生石灰,用于吸收发电厂和焦化厂燃煤时产生的SO2,减少对空气的污染;或建立污水处理系统
.

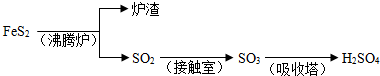
 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1
SO3(g)△H=a kJ?mol-1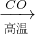 Fe
Fe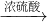 FeSO4;B.Fe2O3
FeSO4;B.Fe2O3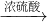 Fe2(SO4)3
Fe2(SO4)3 FeSO4;C.Fe2O3
FeSO4;C.Fe2O3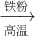 Fe
Fe FeSO4
FeSO4

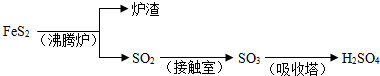
 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1
SO3(g)△H=a kJ?mol-1 Fe
Fe FeSO4;B.Fe2O3
FeSO4;B.Fe2O3 Fe2(SO4)3
Fe2(SO4)3 FeSO4;C.Fe2O3
FeSO4;C.Fe2O3 Fe
Fe FeSO4
FeSO4
