
题目列表(包括答案和解析)
A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
(1)写出A、C、E三种元素的名称:
A ,C ,E 。
(2)甲、乙两分子中含有非极性共价键的是 (填分子式),它的电子式为 。
(3)C、D、F的离子中,半径最小的是 (填离子符号)
(4)BA4的空间构型为 。
甲、乙为短周期同一主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,则满足条件的甲和乙分别为( )
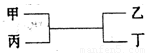
A.铝和铁 B.碳和硅
C.镁和碳 D.氢气和钠
甲、乙为短周期同一主族元素组成的单质,丙、丁为氧化物,它们存在如下转化关系,则满足条件的甲和乙分别为( )
| A.铝和铁 | B.碳和硅 |
| C.镁和碳 | D.氢气和钠 |
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5 为离子化合物,写出其电子式 。
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为:
![]()
该同学所画的电子排布图违背了 。
(4)G位于 族 区。
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是 ,请用原子结构的知识解释产生此
现象的原因是
。
(7)F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为 cm。

Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
② Y原子价电子排布为msnmpn ;
③ R原子核外L层电子数为奇数;
④ Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z在周期表中第 族。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。(填写序号)
a.稳定性:甲>乙,沸点:甲<乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(3)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 , 1 mol该晶体中含有 mol的化学键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com