
题目列表(包括答案和解析)
有一部分被氧化的钠块(氧化部分生成![]() 和
和![]() )5g,与水完全反应,生成气体为1.12L(标准状况),将这些气体引燃后冷却到标准状况,剩余气体为0.336L.求钠块中单质钠、氧化钠、过氧化钠各多少克?
)5g,与水完全反应,生成气体为1.12L(标准状况),将这些气体引燃后冷却到标准状况,剩余气体为0.336L.求钠块中单质钠、氧化钠、过氧化钠各多少克?
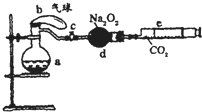 (2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占
(2008?开封一模)如图所示装置中:a是盛有标准状况下的空气(氧气占| 1 | 5 |
| Mg | Al | MgO | Al2O3 | |
| 熔点/℃ | 648.8 | 660.4 | 2852 | 2072 |
| 沸点/℃ | 1107 | 2467 | 3600 | 2980 |
| 燃烧热*/kJ?mol-1 | 601.8 | 833.6 |
若X、 Y两种元素在周期表中位于同一主族,且相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平): Xm + Yn + H2O → HXO3 + HY
请回答:(1)该反应的还原剂的电子式为___________________。
(2)配平上述化学方程式(用化学式表示):
(3)若某化学反应如下:(未配平)
KX + Yn + H2O → KXO3 + Xm + HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目
KX + Yn + H2O →
(4)已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:

①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中生成NaYO3的歧化反应的离子方程式为(用化学式表示): ____________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。已知有2L 3mol/L的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1mol/L。(已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变 )、
若X、Y两种元素在周期表中位于同一主族,其中一种为短周期元素,且两者相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):
Xm + Yn + H2O → HXO3 + HY。请回答:
⑴该反应的还原剂的电子式为___________________。
⑵配平上述化学方程式(用化学式表示):
⑶若某化学反应如下:(未配平)KX + Yn + H2O → KXO3 + Xm + HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目:
KX + Yn + H2O →
⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中由NaYO歧化生成NaYO3的离子方程式为(用化学式表示):______________________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。在2L 3 mol·L-1的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1 mol·L-1。[已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com