
题目列表(包括答案和解析)
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么![]() (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量![]() m(H20),由此计算
m(H20),由此计算![]() 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):

请回答下列问题:[来源:学§科§网Z§X§X§K]
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大![]() 的是_______________ (填序号);
的是_______________ (填序号);
![]() Cu0未完全起反应 ② CuO不
Cu0未完全起反应 ② CuO不![]() 干燥
干燥
![]() Cu0中混有不反应的杂质 ④ 碱石灰不干燥
Cu0中混有不反应的杂质 ④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或__________![]() _____和_______________达到实验目的。
_____和_______________达到实验目的。
选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。做答时用2B铅笔在答题卡上把所选题目的题号涂黑)。
第18、19、20三题的第Ⅰ题为选择题,在给出的四个选项中,至少有两项是符合
题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第Ⅱ题为非选择题,
请在答题卡相应位置做答并写明小题号。
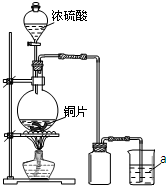 某同学为探究铜跟浓硫酸的反应情况,并收集一瓶SO2气体,设计了如右下图所示装置.实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余.
某同学为探究铜跟浓硫酸的反应情况,并收集一瓶SO2气体,设计了如右下图所示装置.实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余.(16分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液。
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
| 滴定次数 | 盐酸体积 | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
请回答下列问题:
(1)步骤①中,量取20.00mL待测液应使用 (填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果__________(填“偏大”、“偏小”或“无影响”)。
(2)判断到达滴定终点的现象是___________________________________________。
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是___________________(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)由以上数据,该盐酸的物质的量浓度为 ,若要计算盐酸溶液中盐酸的质量分数还缺少的物理量是: ;(请注明单位)。如缺少的数据用字母a表示,则盐酸溶液中盐酸的质量分数为 ;
(5)下列操作会使结果偏高的是 (多选倒扣分)
A.碱式滴定管用蒸馏水洗净后,即注入标准NaOH溶液
B.用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失
C.滴定前,读碱液体积时仰视;滴定后,读碱液体积时俯视
D.滴定前,盛放盐酸的锥形瓶不干燥
(16分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液。
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
|
滴定次数 |
盐酸体积 |
NaOH溶液体积读数(mL) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.00 |
18.10 |
|
2 |
20.00 |
0.00 |
16.30 |
|
3 |
20.00 |
0.00 |
16.22 |
请回答下列问题:
(1)步骤①中,量取20.00mL待测液应使用 (填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果__________(填“偏大”、“偏小”或“无影响”)。
(2)判断到达滴定终点的现象是___________________________________________。
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是___________________(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)由以上数据,该盐酸的物质的量浓度为 ,若要计算盐酸溶液中盐酸的质量分数还缺少的物理量是: ;(请注明单位)。如缺少的数据用字母a表示,则盐酸溶液中盐酸的质量分数为 ;
(5)下列操作会使结果偏高的是 (多选倒扣分)
A.碱式滴定管用蒸馏水洗净后,即注入标准NaOH溶液
B.用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失
C.滴定前,读碱液体积时仰视;滴定后,读碱液体积时俯视
D.滴定前,盛放盐酸的锥形瓶不干燥
(9分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液。
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
| 滴定次数 | 盐酸 体积 体积 | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com