
题目列表(包括答案和解析)
(8分)工业上生产NH4NO3的流程如下:

回答下列问题:
⑴写出NH3催化氧化生成NO的化学方程式 。标准状况下,22.4L NH3全部转化为NO时转移的电子的物质的量为 mol。
⑵某硝酸制造厂将3.4×1010 g的NH3全部用于生产质量分数为63%的浓硝酸(密度为1.42g/mL),由于该厂生产过程中采用先进的循环生产工艺,使NH3100%的转化为HNO3。计算生产中能制得的浓硝酸的体积。
⑶若将3.4×106Kg的NH3一部分用于生产硝酸(转化率仍为100%),一部分用于和生产中得到的硝酸反应生成NH4NO3(转化率也为100%),为使NH4NO3的产量最大化,用于生产硝酸的NH3与用于和生产中得到的硝酸反应生成NH4NO3的NH3的质量比为 。
 (8分)工业上生产NH4NO3的流程如下:
(8分)工业上生产NH4NO3的流程如下:
回答下列问题:
⑴写出NH3催化氧化生成NO的化学方程式 ▲ 。标准状况下,22.4L NH3全部转化为NO时转移的电子的物质的量为 ▲ mol。
⑵某硝酸制造厂将3.4×1010 g的NH3全部用于生产质量分数为63%的浓硝酸(密度为1.42g/mL),由于该厂生产过程中采用先进的循环生产工艺,使NH3100%的转化为HNO3。计算生产中能制得的浓硝酸的体积。
⑶若将3.4×106Kg的NH3一部分用于生产硝酸(转化率仍为100%),一部分用于和生产中得到的硝酸反应生成NH4NO3(转化率也为100%),为使NH4NO3的产量最大化,用于生产硝酸的NH3与用于和生产中得到的硝酸反应生成NH4NO3的NH3的质量比为 ▲ 。
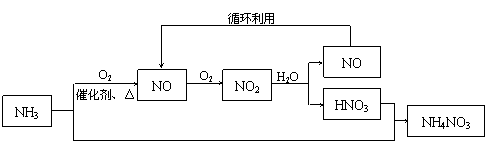 (14分)工业上生产NH4NO3的流程如下:
(14分)工业上生产NH4NO3的流程如下:
(1)写出NH3催化氧化生成NO的化学方程式 ▲ 。标准状况下,22.4L NH3全部转化为NO时转移的电子的物质的量为 ▲ mol。
(2)某硝酸制造厂将3.4×1010 g的NH3全部用于生产质量分数为63%的浓硝酸(密度为1.42g/mL),由于该厂生产过程中采用先进的循环生产工艺,使NH3100%的转化为HNO3。计算生产中能制得的浓硝酸的体积 ▲ m3。
(3)若将3.4×106Kg的NH3一部分用于生产硝酸(转化率仍为100%),一部分用于和生产中得到的硝酸反应生成NH4NO3(转化率也为100%),为使NH4NO3的产量最大化,用于生产硝酸的NH3与用于和生产中得到的硝酸反应生成NH4NO3的NH3的质量比为 ▲ 。www..com
 (14分)工业上生产NH4NO3的流程如下:
(14分)工业上生产NH4NO3的流程如下:
(1)写出NH3催化氧化生成NO的化学方程式 ▲ 。标准状况下,22.4L NH3全部转化为NO时转移的电子的物质的量为 ▲ mol。
(2)某硝酸制造厂将NH3全部用于生产硝酸,由于该厂生产过程中采用先进的循环生产工艺,使NH3100%的转化为HNO3。问在1 mol NH3100%的转化为HNO3过程中需要氧气的物质的量是 ▲ mol。若将NH3一部分用于生产硝酸(转化率仍为100%),一部分用于和生产中得到的硝酸反应生成NH4NO3(转化率也为100%),为使NH4NO3的产量最大化,用于生产硝酸的NH3与用于和生产中得到的硝酸反应生成NH4NO3的NH3的物质的量之比为 ▲ 。
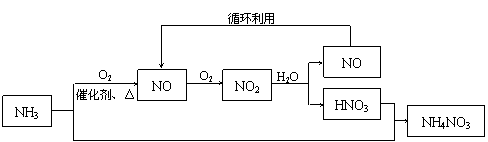 (6分)工业上生产NH4NO3的流程如下:
(6分)工业上生产NH4NO3的流程如下:
(1)写出NH3催化氧化生成NO的化学方程式 ▲ 。标准状况下,22.4L NH3全部转化为NO时转移的电子的物质的量为 ▲ mol。
(2)某硝酸制造厂将3.4×1010 g的NH3全部用于生产质量分数为63%的浓硝酸(密度为1.42g/mL),由于该厂生产过程中采用先进的循环生产工艺,使NH3100%的转化为HNO3。计算生产中能制得的浓硝酸的体积 ▲ m3。
(3)若将3.4×106Kg的NH3一部分用于生产硝酸(转化率仍为100%),一部分用于和生产中得到的硝酸反应生成NH4NO3(转化率也为100%),为使NH4NO3的产量最大化,用于生产硝酸的NH3与用于和生产中得到的硝酸反应生成NH4NO3的NH3的质量比为 ▲ 。www..com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com