
题目列表(包括答案和解析)
(10)(1)氯碱工业是利用电解食盐水生产 ① 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、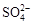 等杂质离子,下列加入顺序合理的是 ②。
等杂质离子,下列加入顺序合理的是 ②。
| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
(10)(1)氯碱工业是利用电解食盐水生产 ① 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、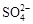 等杂质离子,下列加入顺序合理的是 ② 。
等杂质离子,下列加入顺序合理的是 ② 。
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
|
成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶于酸的物质 |
|
质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
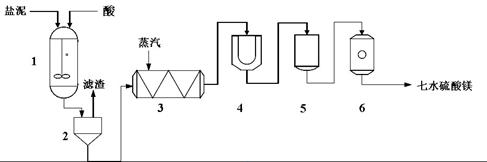
为生产七水硫酸镁,设计了以下工艺流程:
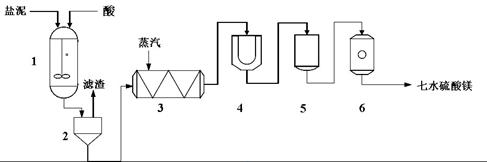
生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用 ③ ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 ④ 。
装置2中滤渣的主要成分为 ⑤ 。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是__⑥__。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是 ⑦ 。
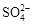 等杂质离子,下列加入顺序合理的是 ②。
等杂质离子,下列加入顺序合理的是 ②。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 正丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |


已知:
|
药品名称 |
熔点/℃ |
沸点(℃) |
密度g/cm3 |
溶解性 |
|
正丁醇 |
-89.5 |
117.7 |
0.8098 |
微溶于水、溶于浓硫酸 |
|
1-溴丁烷 |
-112.4 |
101.6 |
1.2760 |
不溶于水和浓硫酸 |
根据题意完成下列填空:
(一)制备1-溴丁烷粗产品在如图装置的圆底烧瓶中依次加入NaBr,10 mL 正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。
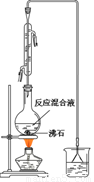
(1)写出制备1-溴丁烷的化学反应方程式:__________________________________________________
(2)反应装置中加入沸石的目的是__________________。配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(3)反应装置中,除了产物和水之外,还可能存在 、 等有机副产物。
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品
将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图装置蒸馏。
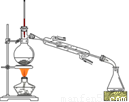
(5)收集产品时,控制的温度应在_________℃左右;区分1-溴丁烷精品和粗品的一种方法是____________________。
(6)实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为 。(保留3位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com