
题目列表(包括答案和解析)
| ||
| a |
| 32 |
| V |
| 22.4 |
| a |
| 32 |
| V |
| 22.4 |
| ||
| A、1:2 | B、1:4 |
| C、2:1 | D、4:1 |
| ||
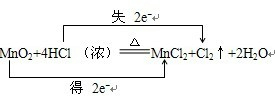

(1)(6分)在反应MnO2 + 4HCl = MnCl2+ 2H2O +Cl2↑中,
①还原剂是 ;
②HCl中,被氧化的Cl原子与未被氧化的Cl原子个数比是 。
③若要产生112mL氯气,则转移的电子数目是 。
(2)、(3分) 将2.3g钠投入水中,充分反应后,得到的溶液中Na+与水分子的个数比为1:100,则反应所需的m(H2O)=________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com