
题目列表(包括答案和解析)
①4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
![]()
③SO3+H2O ![]() H2SO4
H2SO4
其中排放的尾气含少量SO2,为防止污染大气,在排放前应设法进行综合利用。
(1)某硫酸厂每天排放10000m3(换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL2mol·L-1的NaOH溶液使其完全反应,经测定所得溶液含
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3,调节尾气排放的流量,以取得SO2和NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且![]() =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
x=n(SO2)/n(NaOH) | n(NaHSO3) |
|
|
|
|
|
|
提示:该题取材于接触法制硫酸的过程中对废气SO2的处理,即消除了SO2对空气的污染,又使SO2得到综合利用。该题在能力要求上有一定的深度和坡度。第(1)步考查多步反应的计算,所发生的一系列反应较为复杂,但根据S元素守恒找出关系式,即可得出答案。第(2)步涉及平行反应中混合物的计算。反应方程式为2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() NaHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
NaHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
(9分)有强烈气味的无色液体A在100℃蒸馏时,其组成不变。此液体的蒸气密度(相对于空气)随温度而改变,100℃时为1.335,20℃时为1.50。若将液体加到新制的氢氧化铜(取化学计量的碱)中,沉淀溶解,形成淡蓝色溶液。将1g液体A与过量浓硫酸在一起加热时,放出密度(相对于空气)为0.966的气体360mL,若将1g液体A加到含过量MnO2的硫酸溶液中,则放出同样体积的、比前一种气体重1.57倍的另一种气体(体积均以标准状态计)。
8-1 确定液体A的组成,并以必要的计算和反应的化学方程式证明答案。
8-2 为什么蒸馏时此液体的组成不变?为什么它的蒸气的相对密度随温度的变化而变化?
工业上,常用铝作还原剂,从高熔点氧化物中冶炼一些稀有金属,如W、Mo、Co、Ni、Mn、Cr、Ti等.请回答下列问题:
(1)预测反应条件可能是________.
解析:铝热反应是高温下进行的反应(有难熔物质参加的置换反应,通常也是在高温下进行的).
答案:高温
(2)写出下列反应方程式,指出氧化剂和还原剂:
①Al+V2O5:________
②Al+Co3O4:________
某高二化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如表:
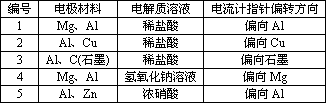
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)答案:________.
(2)对实验3完成下列填空:
①铝为________极,电极反应式:________.
②石墨为________,电极反应式:________.
③电池总反应方程式:________.
(3)实验4中铝作负极还是正极________,理由是________.写出铝电极的电极反应式________.
(4)解释实验5中电流计指针偏向铝的原因:________.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com