
题目列表(包括答案和解析)
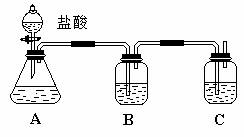
为确认酸性强弱:HCL>H2CO3>H2SiO3,某学生设计了如下图所示的装置,通过一次实验即可达到目的。

请回答下列问题:
(1)锥形瓶中装有某可溶性正盐溶液,该盐在分类上属于 (填“碳酸盐”、“硫酸盐”或“硅酸盐”)。
(2)装置B中所盛的试剂为饱和NaHCO3溶液,其作用是 。
(3)装置C中所盛的试剂是 (填“NaCl”、“Na2CO3”或“Na2SiO3”)溶液,C中反应的离子方程式是 。
为确认下面三种酸的酸性强弱:HCl>H2CO3>H2SiO3,想想同学设计了如图所示的装置,通过一次实验即可达到目的。
 请回答下列问题:
请回答下列问题:
(1)锥形瓶中装有某可溶性正盐溶液,该盐在分类上属于 (填“碳酸盐”、“硫酸盐”或“硅酸盐”)。
(2)装置B中所盛的试剂为饱和NaHCO3溶液,其作用是 。
(3)装置C中所盛的试剂是 (填“NaCl”、“Na2CO3”或“Na2SiO3”)溶液,C中反应的离子方程式是 。
现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3- (2)部分物理参数如下:
|
|
密度 (g·mL-1) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
|
苯甲酸
|
1.2659 |
122.13℃ |
249℃ |
微溶于水,易溶于乙醇、乙醚等有机溶剂 |
|
苯酚
|
1.07
|
40.6
|
181.9
|
易溶于乙醇、乙醚,65℃以上能与水互溶 |
|
乙醇 |
0.79 |
-114.3 °C |
78.5 |
与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |
供选择试剂:10%氢氧化钠溶液、0.1mol/L盐酸、0.1mol/LNa2CO3、0.1mol/L NaHCO3、浓溴水、生石灰、0.1mol/L FeCl3、0.1mol/L BaCl2、CO2、0.1mol/L溴水、澄清石灰水
(1)分离物质流程如下:

①物质C是_____________,操作IV是_____________。
②操作III发生的主要化学反应方程式_________________ _______________________________。
③混合液2中加入生石灰的原因是_______。
(2)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱。
|
实验步骤 |
现象和结论 |
|
①取少量混合液1于试管,滴加________________________, 振荡,静置 |
|
|
②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ |
澄清石灰水变浑浊 说明混合液1含有HCO3- |
|
③另取少量混合液1于试管,滴加___________________,振荡 |
_________________________, 说明混合液1不含有酚羟基 |
(3)称取2.0g苯甲酸和苯酚的混合固体溶于足量乙醇中,滴加足量饱和NaHCO3溶液,测得放出的CO2(标准状况下,不考虑CO2溶于水)为33.6mL ,则苯甲酸的质量分数为_________________________(只列式,不计算),结果为________。(结果保留1位小数)(苯甲酸的相对分子质量为122,苯酚相对分子质量为94)
 →
→ -CH2COOH+HCl
-CH2COOH+HCl →
→ -CH2COOH+HCl
-CH2COOH+HCl| 卤代酸 | F3CCOOH | Cl3CCOOH | F2CHCOOH | FCH2COOH | CH3CH2CHClCOOH |
| pKa | 0.23 | 0.65 | 1.24 | 2.66 | 2.85 |
| 卤代酸 | ClCH2COOH | BrCH2COOH | ICH2COOH | CH3CHClCH2COOH | Cl③CH2CH2CH2COOH |
| pKa | 2.86 | 2.90 | 3.18 | 4.06 | 4.52 |
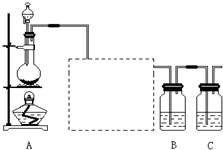 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com