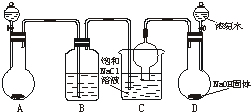
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
①连接好装置,检验气密性,在仪器内装入药品.
②先从D的分液漏斗中连续滴下浓氨水,直到产生的气体不能再在C中的饱和NaCl溶液中溶解时.再通入A中产生的气体.片刻后,烧杯中析出白色固体(碳酸氢钠).继续向C中通入两种气体,直到不再有固体产生为止.
③过滤烧杯内所得的混合物,得到碳酸氢钠固体.
④向滤液中加入适量的氯化钠固体,发生反应:
NaCl(s)+NH
4Cl(aq)=NaCl(aq)+NH
4Cl(s),搅拌后过滤,滤出物可用作化肥.
⑤滤液再注入烧杯C中,重复使用,进行下一次制备…
试回答下列问题:
(1)检验装置A气密性的方法是
用手握住装置A的烧瓶(或微热),看到B瓶中玻璃管口和C中左边玻璃管口有气泡冒出,将手拿开,玻璃管内部形成一段水柱,说明装置A及左半部分气密性良好
用手握住装置A的烧瓶(或微热),看到B瓶中玻璃管口和C中左边玻璃管口有气泡冒出,将手拿开,玻璃管内部形成一段水柱,说明装置A及左半部分气密性良好
.
(2)烧杯C中发生反应的化学方程式为
NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
.
(3)A中常选用的固体为
CaCO3
CaCO3
;B中应选用的液体为
和NaHCO3溶液或水或饱和食盐水
和NaHCO3溶液或水或饱和食盐水
.
(4)步骤②中必须先让D中发生反应,产生气体后,再让A中发生反应产生气体,原因是
NH3在水中的溶解度比CO2大,先通NH3有利于吸收更多的CO2,从而生成更多的NaHCO3
NH3在水中的溶解度比CO2大,先通NH3有利于吸收更多的CO2,从而生成更多的NaHCO3
.
(5)步骤④是在较高温度(如60℃)下还是在较低温度下(如0℃~10℃)下进行合适?
较低
较低
(填“较高”或“较低”)
(6)步骤④中所得的氯化铵晶体中常含有少量的氯化钠和碳酸氢钠(约占5%~8%),请设计简单的实验证明所得固体的成分大部分是氯化铵.简要写出操作方法、现象和结论.
取少量样品于试管中,用酒精灯加热,看到试管上端有白烟生成(或试管口有白色晶体),最后剩余极少量的固体,从而证明所得固体的成分大部分是氯化铵
取少量样品于试管中,用酒精灯加热,看到试管上端有白烟生成(或试管口有白色晶体),最后剩余极少量的固体,从而证明所得固体的成分大部分是氯化铵
.




 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为: