高铁酸钾(K
2FeO
4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl
2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe
3++3OH
-=Fe(OH);②______.
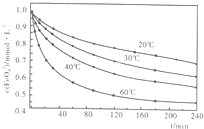
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)
3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物.将适量K
2Fe
2O
4溶液于pH=4.74的溶液中,配制成c(FeO
2-4)=1.0mmol?L
-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO+2-
4)的变化,结果见图.高铁酸钾与水反应的离子反应方程式为______,该反应的△H______0(填“>”“<”或“=”).
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K
2FeO
4+8H
2O
3Zn(OH)
3+2Fe(OH)
3+4KOH该电池放电时的负极反应式为______,若外电路有5.418×10
22个电子通过,则正极有______g高铁酸钾参与反应.
(4)测定某K
2FeO
4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K
2FeO
4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO
-2与FeO
2-4反应生成Fe(OH)
3和CrO
2-4步骤3:加足量稀硫酸,使CrO
2-4转化为Cr
2O
2-7,CrO
-2转化为Cr
3+,Fe(OH)
3转化为Fe
2+步骤4:加入二苯胺磺酸钠作指示剂,用c mol?L
-1(NH
4)
2Fe(SO
4)
2标准溶液滴定至终点,消耗(NH
4)
2Fe(SO
4)
2溶液V
1mL.
①滴定时发生反应的离子方程式为______.
②原溶液中K
2FeO
4的浓度为______(用含字母的代数式表示).