
题目列表(包括答案和解析)
实验室可通过多条途径得到氮气,常见的三种方法是:
方法一:将氨气通过灼热的氧化铜粉末,得到纯净的氮气和铜。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
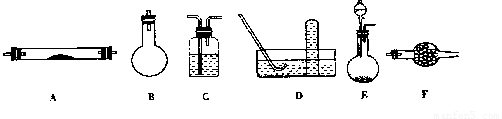
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、
酒精灯等未列出):
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)
_________作发生装置,该反应的化学方程式_________________________。
要制取并收集纯净的氮气(可含有少量的水),还应使用上述仪器中的(填仪器的编号,
并按气流方向从左向右列出)_______________________________________________。
(2)制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。
这两种方法与方法三相比,其优越性在于①____________ ______________________,
②_________________________________________。(至少写两点)
(9分)已知,向Zn2+离子溶液中滴加氨水,生成Zn(OH)2白色沉淀;但是氨水过量时,沉淀又溶解,生成了Zn(NH3)42+。此外,Zn(OH)2既可溶于盐酸,也可溶于过量NaOH溶液中,生成ZnO22-,所以Zn(OH)2是一种两性氢氧化物。
现有3组离子,每组有2种金属离子。请各选用1种试剂,将它们两者分开。可供选用的试剂有:A 硫酸 B 盐酸 C 硝酸 D 氢氧化钠溶液 E 氨水(填写时用字母代号)
请填写下表:
|
离子组 |
选用的试剂(填代号) |
沉淀物的化学式 |
保留在溶液中的离子[[来源:七彩教育网.COM] |
|
Zn2+和Al3+ |
|
|
[来源:七彩教育网.COM] |
|
Zn2+和Ba2+ |
|
|
|
|
Fe3+和Al3+ |
|
|
|
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+
H2O(g)==== CO (g)+3H2(g)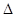 H
= +206.2 kJ·mol-1
H
= +206.2 kJ·mol-1
CH4(g)+ CO2(g)==== 2CO
(g)+2H2(g) 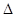 H = +247.4 kJ·mol-1
H = +247.4 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______________________________。
(2)电解尿素[CO(NH)]的碱性溶液制氢的装置示意图见图:
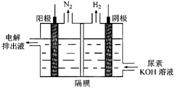 (电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极排出液中含有大量的碳酸盐成份,则阳极的电极反应式为_______,每消耗1mol尿素需要补充______mol氢氧化钾。
(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极排出液中含有大量的碳酸盐成份,则阳极的电极反应式为_______,每消耗1mol尿素需要补充______mol氢氧化钾。
实验室可通过多条途径得到氮气,常见的三种方法是:
方法一:将氨气通过灼热的氧化铜粉末,得到纯净的氮气和铜。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、
酒精灯等未列出):
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)
_________作发生装置,该反应的化学方程式_________________________。
要制取并收集纯净的氮气(可含有少量的水),还应使用上述仪器中的(填仪器的编号,
并按气流方向从左向右列出)_______________________________________________。
(2)制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。
这两种方法与方法三相比,其优越性在于①____________ ______________________,
②_________________________________________。(至少写两点)
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)==== CO (g)+3H2(g)![]() H= +206.2 kJ·mol-1
H= +206.2 kJ·mol-1
CH4(g)+ CO2(g)==== 2CO(g)+2H2(g)  H = +247.4 kJ·mol-1
H = +247.4 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______________________________。
(2)电解尿素[CO(NH)]的碱性溶液制氢的装置示意图见图:
(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极排出液中含有大量的碳酸盐成份,则阳极的电极反应式为_______,每消耗1mol尿素需要补充______mol氢氧化钾。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com