(1)硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为
FeS
2.850℃~900℃时,
硫铁矿在在沸腾炉中煅烧,发生下列反应:
4FeS
2+11O
2→2Fe
2O
3+8SO
2(杂质不与氧气反应)
设120kg纯净的FeS
2与氧气完全反应,产生标准状况下SO
244.8
44.8
m
3.
(2)0.65mol铜与100ml、18mol/L的浓硫酸充分反应后,铜完全溶解,将所得溶液稀释到10L,在此溶液中滴加5mol/L的氢氧化钠溶液至沉淀质量最大时,需氢氧化钠溶液
460
460
ml.
(3)在100mL NaOH溶液中加入NH
4NO
3和(NH
4)
2SO
4的固体混合物,加热使之充分反应.
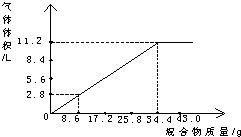
如图是加入的混合物质的质量和产生的气体体积(标准状况)的关系.则NaOH的物质的量浓度为
5
5
mol/L
(4)某Na
2SO
3固体已部分被氧化为Na
2SO
4,经测定该混合物中含硫的质量分数为25%,取51.2g该混合物加入某浓度过量的硫酸50mL,加热使气体全部逸出并收集,然后再向溶液中加入0.5mol/L氢氧化钠溶液50mL恰好中和余酸.求:硫酸溶液的物质的量浓度(要求解答过程)

