
题目列表(包括答案和解析)
(12分)在一个容积为0.5L的密闭容器中,将 2 mol CO和6mol H2O混合加热到800℃,发生反应:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g),经过5min后达到平衡状态。若此时测得H2的浓度为3 mol·L-1,求:
CO2(g)+ H2(g),经过5min后达到平衡状态。若此时测得H2的浓度为3 mol·L-1,求:
(1)以CO的浓度变化表示的该反应的速率。
(2)达平衡时H2O的转化率。
(3)已知:在一定温度下,该反应达平衡时,各物质的平衡浓度之间存在以下关系:
![]()
且当温度不变时K为常数,K不随反应物、生成物浓度的改变而改变。求:
①在800℃下,该反应的K= ;ww w.ks 5u.co m
②在800℃下,当投入1 mol CO和4 mol H2O混合加热到平衡时,H2浓度是多少。
(27分)有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Z2的电子式为 ,Y的原子结构示意图为 ,YW2的结构式为 。
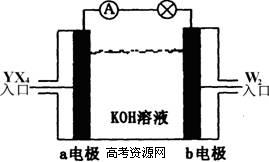
(2)将YX4、W2按上图所示通入某燃料电池中,则两极的电极方程式分别为:
a电极: ,b电极: 。若有16gW2参加反应,转移的电子数是 。
(3)已知在120℃、101kPa下, 0.5mol X2在W2中完全燃烧时,释放出120.9kJ的热量,该反应的热化学方程式为 。
(4)Y和Z结合可生成一种超硬物质,本身耐磨损,抗腐蚀,则该物质属于 晶体,该晶体中各粒子均满足8电子稳定结构,则化学式为 。ww w.ks 5u.co m
(10分)氯化铁是常见的水处理剂w ww.ks 5u.co m,无水FeCl3的熔点为555 K、沸点为588 K。工业上制备无水FeCl3的一种工艺如下:
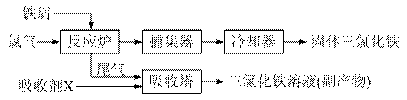
⑴取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片得红褐色氢氧化铁胶体,其离子方程式可表示为: ▲ ,胶体粒子的直径一般不超过 ▲ 。
⑵吸收塔中吸收剂X是 ▲ 。
⑶温度超过673 K,捕集器中的物质相对分子质量为325,该物质的分子式为 ▲ 。
⑷通常用碘量法测定FeCl3的质量分数:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶,用蒸馏水定容;取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去V mL。则样品中氯化铁的质量分数为: ▲ 。
(6分)已知:
① CaCO3 (s) ![]() CaO (s) + CO2 (g) Δ H = +178.2 kJ·mol-1
CaO (s) + CO2 (g) Δ H = +178.2 kJ·mol-1
② 2Na (s) + Cl 2 (g) ![]() 2NaCl (s) Δ H = -822.0 kJ·mol-1
2NaCl (s) Δ H = -822.0 kJ·mol-1
③ H-H、Cl-Cl和 H-Cl的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1
则:ww w.ks 5u.co m
(1)上述反应①②中属于放热反应的是 (填序号)。
(2)根据②计算生成1 mol NaCl(s)时,Δ H = ____ kJ·mol-1。
(3)根据③推算:Cl 2 (g) + H2 (g) ![]() 2HCl (g) 的Δ H = kJ·mol-1。
2HCl (g) 的Δ H = kJ·mol-1。
现有两种不含结晶水的盐,它们在不同温度下的溶解度如下表:
| 20℃ | 50℃ | |
| A的溶解度 | 35.7 g | 46.4 g |
| B的溶解度 | 31.6 g | 108 g |
下列说法中,正确的是w ww.ks 5u.co m
A.可采用重结晶法使A、B混合物分离
B.A的溶解度一定大于B的溶解度
C.20℃时,无法配制30%的A的不饱和溶液
D.将208 g B的饱和溶液降温到20℃,析出76.4 g B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com