
题目列表(包括答案和解析)
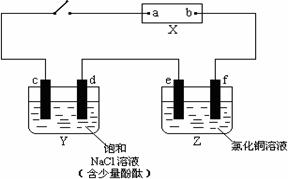
右图中X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。
(1)①.写出c极上反应的电极反应式 。
②.写出Y槽中总反应化学方程式 。
③.写出Z槽中e极上反应的电极反应式 。
(2)请写出具体的计算过程:
①.若电解2min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为 mol
②.若Y槽中溶液体积为500mL(电解后溶液体积可视为不变),则槽中单位时间内氢氧根离子浓度的变化是 mol/(L.min)。
| |||||||||||||||
下列有关化学用语表示正确的是

A.右图中的①是N2的电子式
B.右图中的②是S2-的结构示意图
C.质子数为53,中子数为78的碘原子:13153I
D.右图中的③是邻羟基苯甲酸的结构简式
甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容器密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
|
在相同温度时,向A容器中充入1molCH2OH(g)
和2molH2O(g),向B容器中充入1.2molCH3OH(g)
和2.4molH2O(g),两容器分别发生上述反应。
已知起始时容器A和B的体积均为aL。试回答:
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 A、B两容器中H2O(g)的体积百分含量的大小关系为:B(填“>”、“<”、“=”) A。
②若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(13分) 工业原料甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H > 0
CO2(g)+3H2(g) △H > 0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的反应速率 。
(2)右图中P是可自由平行滑动的活塞,关闭K,在相同温度下,向A容器中充入1 mol CH3OH和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知,起始时容器A和B的体积均为a L。试回答:

① 反应达到平衡时,容器B的体积为1.5 a L,B容器中CH3OH转化率为 ,A、B两容器中H2O(g)的体积百分含量的大小关系为B A(填“>”、“<”、“=” )
② 若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(3)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
(4)甲醇等有机物在空气中燃烧时由于燃烧不充分可能会产生CO等污染物。有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com