
题目列表(包括答案和解析)
下表中的实线表示元素周期表部分边界。途中的字母分别表示元素周期表中对应位置的元素。

(1)请在上面的元素周期表中用实线画出周期表未完成的边界。
(2)表中字母对应的元素中,非金属性最强的元素的名称是 ,请用一个化学方程式表示出该元素的非金属性比e对应元素强 。
(3)第三周期的8种元素按单质熔点大小
顺序的柱形图如右所示,
其中序列“8”所对应元素的元素符号是 。
(4)现有b、d、h三种元素的氢化物,其中沸点最高的氢化物的空间构型是 。
(5)i对应的元素的最高价氧化物对应水化物的电离方程式为 。
Ⅱ、(5分)现有下列短周期元素的性质数据:
编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(10-10) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
试回答下列问题:
(1)上述元素中处于第ⅤA族的有 ,处于第二周期的有
(以上均用编号回答)
(2)上述元素中金属性最强的是 (用编号回答)
(3)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)
即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于或等于
原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素。试回答:
a、第n(n≥2)周期有 种非金属元素(含零族元素)
b、根据周期表中每个周期非金属元素的种数(含零族元素),预测目前的周期表若填满后还有 种非金属元素未被发现。

 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1
SO3(g)△H=a kJ?mol-1| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
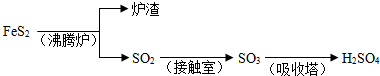
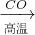 Fe
Fe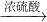 FeSO4;B.Fe2O3
FeSO4;B.Fe2O3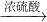 Fe2(SO4)3
Fe2(SO4)3 FeSO4;C.Fe2O3
FeSO4;C.Fe2O3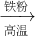 Fe
Fe FeSO4
FeSO4
| 1 |
| 2 |
| ||
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| ||
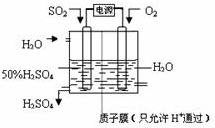
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |

 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1
SO3(g)△H=a kJ?mol-1| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
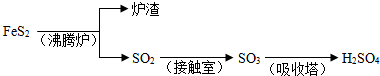
 Fe
Fe FeSO4;B.Fe2O3
FeSO4;B.Fe2O3 Fe2(SO4)3
Fe2(SO4)3 FeSO4;C.Fe2O3
FeSO4;C.Fe2O3 Fe
Fe FeSO4
FeSO4
| 1 |
| 2 |
| ||
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com