
题目列表(包括答案和解析)
(8分)将一定量氯气通入刚吸收过少量SO2的NaOH溶液,所得溶液仍显强碱性。
(1) 请完成SO2与过量NaOH溶液反应的化学方程式
(2) 所得溶液中一定存在的阴离子为SO42—和
(3) 设计实验方案,探究所得溶液中是否含有SO32-或ClO—。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH、0.01 mol·L-1KMnO4、淀粉-KI溶液、紫色石蕊 试液.
试液.
 试液.
试液.
 实验室在没有浓盐酸的情况下,常用浓硫酸、食盐和二氧化锰在加热条件下制取氯气,发生反应的化学方程式为2NaCl+3H2SO4(浓)+MnO2
实验室在没有浓盐酸的情况下,常用浓硫酸、食盐和二氧化锰在加热条件下制取氯气,发生反应的化学方程式为2NaCl+3H2SO4(浓)+MnO2
|
| 选用的仪器 | 加入试剂 |
| A | 食盐粉末、二氧化锰、浓硫酸 |
| B | 紫色石蕊试液 |
| 淀粉-KI溶液 | |
(12分)氯化铁是常见的水处 理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下: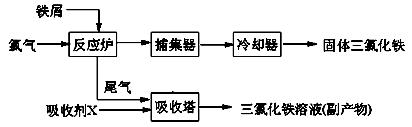
(1)试写出吸收塔中反应的离子方程式: 。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |

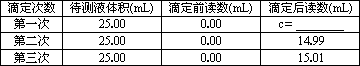
| 滴定次数 | 待测液体积(mL) | 滴定前读数(mL) | 滴定后读数(mL) |
| 第一次 | 25.00 | 0.00 | c= |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K.工业上制备无水FeCl3的一种工艺如下:
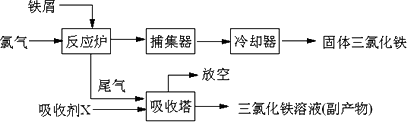
(1)试写出吸收塔中反应的离子方程式:________.
(2)已知六水合氯化铁在水中的溶解度如下:
从FeCl3溶液中获得FeCl3·6H2O的方法是:________.
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=________mol/L(已知:Ksp[Fe(OH)3]=1.1×10-36).
(4)FeCl3的质量分数通常可用碘量法测定:称取6克无水氯化铁样品,溶于稀盐酸,再转移到250 mL容量瓶,用蒸馏水定容;取出25 mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1 mol/L Na2S2O3溶液滴定用去V mL.
(已知:2Fe3++2I-=I2+2Fe2+ I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:________.
②滴定至终点,实验数据如下表所示:(第一次滴定终点的数据如下图中c点所示,请将你读得的数据填入表中)
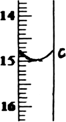
则样品中氯化铁的质量分数为________(写出最终的计算结果).
③下列操作可能使测定结果偏低的是________.
A.滴定管在注入溶液前用蒸馏水洗后未用标准液润洗
B.开始时碱式滴定管尖嘴部分留有气泡,滴定过程中消失
C.盛FeCl3溶液的锥形瓶滴定前用FeCl3溶液润洗了2次
D.滴定前仰视滴定管读数,滴定后平视滴定管读数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com