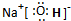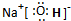A、B、C、D、E五种短周期元素,它们的原子序数依次增大.B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零.D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为
-n.请回答下列问题:
(1)B元素是
碳
碳
,D元素在周期表中的位置是
第二周期第ⅥA族
第二周期第ⅥA族
;
(2)C与E形成的化合物E
3C属于
离子
离子
晶体(填“原子”、“离子”或“分子”);
(3)由A、D、E元素组成的化合物中存在的作用力是
离子键、共价键
离子键、共价键
;
(4)写出一个E和D形成的化合物与水反应的化学方程式
Na2O+H2O=2NaOH或2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2NaOH或2Na2O2+2H2O=4NaOH+O2↑
;
(5)C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,X的水溶液显
酸
酸
性(填“酸”、“碱”或“中”),其原因用离子方程式表示:
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.