
题目列表(包括答案和解析)
| 序号 | 实验操作 | 实验现象 | I | 稀硫酸中加入铜片 | 无明显变化 | II | 硝酸钠溶液中加入铜片 | 无明显变化 | III | 稀硫酸中加入硝酸钠溶液 | 无明显变化 | 再加入铜片 | 有无色气泡;溶液变蓝 |
| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 | E.生成白色胶状沉淀,继而沉淀消失 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ |
| 实验现象(填A~F) | C | D |
| 浓硫酸 | 170℃ |

|
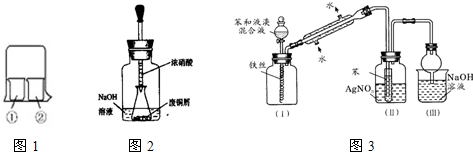
Ⅱ.实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%—30%的稀硫酸溶液,在50℃—80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:__________________________________。
(2)硫酸溶液过稀会导致_________________________________________________。
(3)采用水浴加热的原因是__________________________________________________。
(4)反应时铁屑过量的目的是(用离子方程式表示)____________________________。
(5)溶液趁热过滤的原因是______________________。塞紧试管口的目的是__________________________。
(6)静置冷却一段时间后,在试管中观察到的现象是_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com