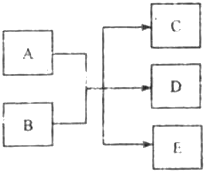
(2011?河西区一模)在一定条件下,物质A~E相互转化的关系如下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
(1)若A、C、D中均含有氯元素,其中氯的化合价由低到高的顺序为C、A、D.C为氯碱工业的原料,D的溶液有漂白性.则D的电子式为
:则A与B反应的离子方程式是
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
;
(2)若B为短周期某种元素X的最高价氧化物的水化物.
①若A为亮红色固体,在加热条件下能与B的浓溶液反应,但不能与B的稀溶液反应,则元素x在周期表中的位置是
第三周期第ⅥA族
第三周期第ⅥA族
:若在常温下A与B的浓、稀溶液均能反应,则A与B的稀溶液反应的高于方程式是
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
.
②若A为黑色固体,在加热条件下与B的浓溶液反应产生两种无色气体,则此反应的化学方程式是
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
.
(3)已知(1)中的B溶液电离出的阴离子M与(2)中的B溶液电离出的阳离子N都是10电子粒子,当100mL 0.5mol/L的M与100mL 0.55mol/LN完全反应生成E时放出akJ热量,该反应的热化学方程式为
H3O+(aq)+OH-(aq)=2H2O(l)△H=-20akJ/mol
H3O+(aq)+OH-(aq)=2H2O(l)△H=-20akJ/mol
.

 (2011?河西区一模)在一定条件下,物质A~E相互转化的关系如下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
(2011?河西区一模)在一定条件下,物质A~E相互转化的关系如下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
