
题目列表(包括答案和解析)
工业上从海水制取溴时,是以氯气氧化海水中的Br-,然后用空气将溴吹出,以氢氧化纳溶液吸收(Br2跟烧碱生成NaBr和NaBrO3)。再用硫酸酸化得单质溴。
(1)写出各步反应的化学方程式(写出其中任意两个)。
(2)如海水中溴的含量为0.027%.计算多少吨海水可制得1.0t溴 (假定溴无损失)。
工业上从海水制取溴时,是以氯气氧化海水中的Br-用空气将溴吹出,以氢氧化钠溶液吸收(Br2跟烧碱生成NaBr和NaBrO3),再用硫酸酸化得单质溴.
(1)写出前两步反应的化学方程式.
(2)如海水中溴的含量为0.027 %,计算多少吨海水可制得1.0 t溴.(假定溴无损失)
(1)写出前两步反应的化学方程式.
(2)如海水中溴的含量为0.027 %,计算多少吨海水可制得1.0 t溴.(假定溴无损失)
(10分)右面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图: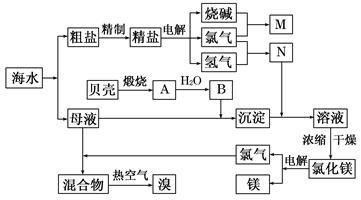
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液。则加入试剂的顺序是(填编号) 。
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,叙述错误的是 。
A.精制饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式: 。
(4)利用MgCl2· 6H2O可制得无水氯化镁,应采取的措施是 。
(5)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
。
(10分)右面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
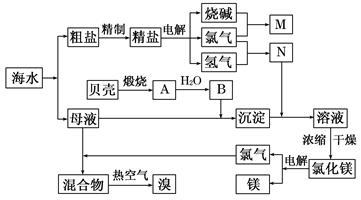
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液。则加入试剂的顺序是(填编号) 。
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,叙述错误的是 。
A.精制饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式: 。
(4)利用MgCl2· 6H2O可制得无水氯化镁,应采取的措施是 。
(5)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com