
题目列表(包括答案和解析)
下列说法中正确的是
[ ]
A.构成单质分子的微粒一定含有共价键
B.不同的三种元素组成的化合物中一定含有离子键
C.化学键指两个或多个原子之间强烈的相互作用
D.阴、阳离子之间的吸引力和排斥力达平衡时形成离子键
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | ——- | -3 | -2 | |
 尿素(
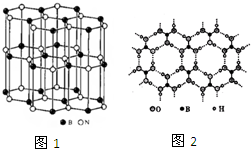
尿素(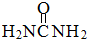 )和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:
)和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com