
题目列表(包括答案和解析)
| A.用100mL的容量瓶准确量取100mL液体 |
| B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C.用托盘天平称量NaCl时,NaCl放在纸上; 称量NaOH时,NaOH放在小烧杯里 |
| D.用加热的方法提取NH4C1固体中的少量碘单质 |
(7分)Ⅰ、下列说法不正确的是 。
| A.用100mL的容量瓶准确量取100mL液体 |
| B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C.用托盘天平称量NaCl时,NaCl放在纸上; 称量NaOH时,NaOH放在小烧杯里 |
| D.用加热的方法提取NH4C1固体中的少量碘单质 |
元素周期表不仅对元素进行了分类,也揭示了一系列的科学观念,如结构决定性质、量变引起质变、复杂现象中蕴涵着简洁的规律等,这对科学的发展等起到了积极的作用。下列说法中正确的是( )
A.在元素周期表中,随着原子序数的递增,原子的半径逐渐减小
B.主族元素原子次外电子层上的电子数与其在元素周期表中的位置有关
C.根据卤族元素砹(At)在元素周期表中位置,可推知HAt受热不易分解
D.水的稳定性比氨的稳定性强,磷酸的酸性比硝酸的酸性弱
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:

回答下列问题:(各元素用相应的元素符号表示)
⑴写出X和Y形成的化合物的电子式 。
⑵阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反
应的化学方程式
⑶写出反应②的化学方程式为 。
⑷某温度下在容积固定的密闭容器中,下列反应达到平衡:
M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=
—44kJ/mol,写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、
2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
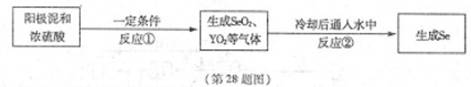
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式 。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式 。
(3)写出反应②的化学方程式为 。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)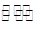 N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com