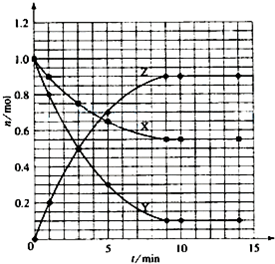
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
| tmin |
Xmol |
Ymol |
Zmol |
| 0 |
1.00 |
1.00 |
0.00 |
| 1 |
0.90 |
0.80 |
0.20 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.55 |
0.10 |
0.90 |
| 10 |
0.55 |
0.10 |
0.90 |
| 14 |
0.55 |
0.10 |
0.90 |
(1)体系中发生反应的化学方程式是
X+2Y

2Z
X+2Y

2Z
;
(2)列式计算该反应在0~3min时间内产物Z的平均反应速率:
0.083mol/(L?min)
0.083mol/(L?min)
;
(3)该反应达到平衡时反应物X的转化率α等于
45%
45%
;

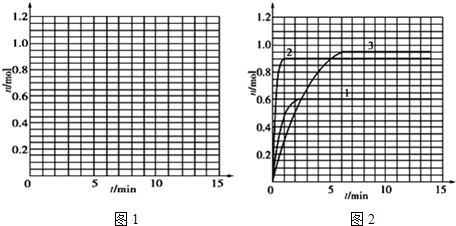
(4)对于上述反应在维持其他条件不变的情况下只改变一种实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如图所示)则曲线1、2、3所对应的实验条件改变分别是:1
升高温度
升高温度
,2
加入催化剂
加入催化剂
,3
增大压强
增大压强
.该反应的△H
<
<
0(填“>”、“<”或“=”),判断理由是:
曲线1表示升高温度Z平衡时物质的量减小,平衡逆向移动,
因此正反应为放热反应则有△H<0
曲线1表示升高温度Z平衡时物质的量减小,平衡逆向移动,
因此正反应为放热反应则有△H<0
.

 某温度时,在2L密闭容器中气态物质CO和H2反应生成气态物质Z,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质CO和H2反应生成气态物质Z,它们的物质的量随时间的变化如下表所示. 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示. 2Z
2Z 2Z
2Z 2Z
2Z 2Z
2Z

 (2)体系中发生反应的化学方程式是
(2)体系中发生反应的化学方程式是