
题目列表(包括答案和解析)
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
某研究性学习小组做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体和白色不溶物。该小组同学通过如下实验,验证产物并探究反应原理。
实验①:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞试液的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
Ⅰ、定性实验
(1)气体的检验
实验②:将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色。则气体为?????????? 。
(2)该小组同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 ??
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2?xMgCO3]
请设计一个实验检验固体中是否含有MgCO3,写出实验操作、现象和结论:??????????????????????????????????????????????????????????????????????????????????? 。
(3)实验③:取实验①中的滤液,向其中加入少量CaCl2稀溶液,产生白色沉淀,溶液红色变浅,说明溶液中存在CO32-离子。
Ⅱ、定量实验
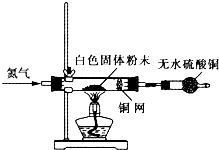
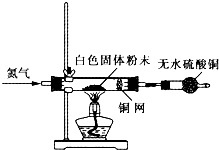
(4)为进一步确定实验I的白色不溶物的成分,进行以下定实验,装置如图所示:

称取干燥、纯净的白色不溶物 7.36 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64 g。白色不溶物的化学式为???????????????? 。
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式??????????????????????????? 。
Ⅲ、反应原理分析
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因:????????????????????????????????????? 。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因:????????????????????????????????????? 。
某研究性学习小组做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体和白色不溶物。该小组同学通过如下实验,验证产物并探究反应原理。
实验①:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞试液的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
Ⅰ、定性实验
(1)气体的检验
实验②:将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色。则气体为 。
(2)该小组同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2?xMgCO3]
请设计一个实验检验固体中是否含有MgCO3,写出实验操作、现象和结论: 。
(3)实验③:取实验①中的滤液,向其中加入少量CaCl2稀溶液,产生白色沉淀,溶液红色变浅,说明溶液中存在CO32-离子。
Ⅱ、定量实验
(4)为进一步确定实验I的白色不溶物的成分,进行以下定实验,装置如图所示:
称取干燥、纯净的白色不溶物 7.36 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64 g。白色不溶物的化学式为 。
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式 。
Ⅲ、反应原理分析
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。

 H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com