
题目列表(包括答案和解析)
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为__________,其分子属于__________(填“极性”或“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氢氧化钠溶液反应的离子方程式__________________________________。
(3)一定条件下,A的气体单质与B的气体单质充分反应生成
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电极的M极通入A气体,N极通入C气体,则N极的电极反应式为________________。
(5)在
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)写出F在周期表中的位置________。画出D的离子结构示意图___________。
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为_______________。1gA的单质与C的单质完全反应生成Y(Y为液态),放出142.9KJ的热量,请写出该反应的热化学方程式_______________________。
(3)C与F形成的常见化合物属于_________晶体。若E的单质是常见的半导体材料,则A与B形成的常见化合物R、C与D形成的常见化合物S、C与E 形成的常见化合物T, R、S、T三者的沸点从高到低排列为___________________________(写化学式)。
(4)画出B单质的结构式_______________。最近科学家合成出了B元素形成的B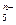 电子式
电子式 ,则n值为___ 。
,则n值为___ 。
(5)A的单质与C的单质在KOH的溶液中可以形成原电池,已知M、N均为碳电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则N极的电极反应式为____________________________________。
(6)在10L的密闭容器中,通入2molFC2气体和3mol C的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol·L—1,则平衡时FC2的转化率为________。
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)写出F在周期表中的位置________。画出D的离子结构示意图___________。
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为_______________。1gA的单质与C的单质完全反应生成Y(Y为液态),放出142.9KJ的热量,请写出该反应的热化学方程式_______________________。
(3)C与F形成的常见化合物属于_________晶体。若E的单质是常见的半导体材料,则A与B形成的常见化合物R、C与D形成的常见化合物S、C与E 形成的常见化合物T, R、S、T三者的沸点从高到低排列为___________________________(写化学式)。
(4)画出B单质的结构式_______________。最近科学家合成出了B元素形成的B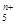 电子式
电子式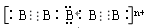 , 则n值为___ 。
, 则n值为___ 。
(5)A的单质与C的单质在KOH的溶液中可以形成原电池,已知M、N均为碳电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则N极的电极反应式为____________________________________。
(6)在10L的密闭容器中,通入2molFC2气体和3mol C的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol·L—1,则平衡时FC2的转化率为________。
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B 与C同周期,A与D、C与F分别在同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为______________,其分子属于___________(填“极性”、“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氧氧化钠溶液反应的离子方程式______________________________________。
(3)一定条件下,A的气体单质与B的气体单质按n(A) : n(B)=3:1充分反应生成6.8 g气态W时放出18.44 kJ热量,则该反应的热化学方_______________________________。
(4)在10 L的密闭容器中,通入2 mol的FC2气体和3 mol C的气体单质在一定条件下反应生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol?L-1,则平衡时FC2的转化率为__________ __。
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为____________,其分子属于______________(填“极性”“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氢氧化钠溶液反应的离子方程式_____________________________________________________________________。
(3)一定条件下,A的气体单质与B的气体单质充分反应生成6.
(4)A的单质与c的单质在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A气体,N极通入C气体,则N极的电极反应式为____________________。
(5)在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com