
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu
2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu
2S(s)+3O
2(g)=2Cu
2O(s)十2SO
2(g)△H=-768.2KJ?mol
-12Cu
2O(s)+Cu
2S(s)=6Cu(s)+SO
2(g)△H=+116.0KJ?mol
-1则反应Cu
2S(s)+O
2(g)=2Cu(s)+SO
2(g)的△H=
-217.4kJ?mol-1
-217.4kJ?mol-1
.
(2)硫酸生产中涉及反应:2SO
2(g)+O
2(g)?2SO
3(g).
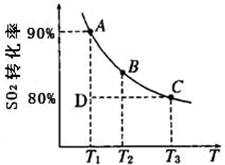
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H
<
<
O(填“>”或“<”).反应进行到状态D时,v
正>
>
v
逆(填“>”、“<”或“=”).?
②某温度时,将4molSO
2和2molO
2通入2L密闭容器中,10min时反应达到平衡状态,测得SO
3的浓度为1.6mol?L
-1,则0~10min内的平均反应速率v(SO
2)=
0.16nol/(L?min)
0.16nol/(L?min)
,该温度下反应的平衡常数K=
80L?mol-1
80L?mol-1
.
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
AB
AB
A.容器内压强不再发生变化 B.SO
2的体积分数不再发生变化?
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化?
④以下操作将引起平衡向正反应方向移动并能提高SO
2转化率的是
A
A
?
A.向容器中通入少量O
2 B.向容器中通入少量SO
2?C.使用催化剂 D.升高温度?E.恒容通入少量氦气?
⑤气体SO
2是大气污染物,可选用下列试剂中的
cd
cd
吸收.
a.浓H
2SO
4 b.稀HNO
3 c.NaOH溶液 d.氨.

 运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义. (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位.