
题目列表(包括答案和解析)
摩尔是表示________的单位,每摩尔物质均含有________个粒子.12 g 12 C中含有的碳原子数约为________个,1 mol H2O分子约含有________个电子.
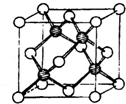 Ⅰ.(1)碳是形成化合物最多的元素,其单质与化合物广布于自然界.CS2是一种重要的有机溶剂,其结构与CO2相似,CS2分子中中心原子的杂化类型为
Ⅰ.(1)碳是形成化合物最多的元素,其单质与化合物广布于自然界.CS2是一种重要的有机溶剂,其结构与CO2相似,CS2分子中中心原子的杂化类型为

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com