
题目列表(包括答案和解析)
下列说法或表达正确的是(??? )
①活性炭、SO2和HClO都具有漂白作用,且漂白原理相同
②向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2=2 Fe3++2Br2+6Cl-
③电解精炼铜时,以粗铜作阴极,纯铜作阳极
④钢铁的吸氧腐蚀负极电极反应式 :Fe-3e-=Fe3+
⑤碳酸氢根离子的电离方程式可表示为: HCO3- +? H2O H3O++ CO32-
H3O++ CO32-
⑥SiO2 虽是酸性氧化物,但其不溶于水,因此不能与NaOH溶液反应
⑦ CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在
⑧浓硫酸具有脱水性,所以可以做干燥剂
A.②④⑧????? B.②⑤?????? C.③④⑥????? D.④⑤?
A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为 。
(2)B2 A和X的分子结合质子 的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为 ,Q为 (填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式 。
(6)已知工业合成X的反应方程式:D2
(g)+3B2 (g)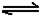 2X(g);△H
=-92.4 kJ·mol-1 ,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H
=-92.4 kJ·mol-1 ,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
下列说法或表达正确的是( )
①活性炭、SO2和HClO都具有漂白作用,且漂白原理相同
②向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2="2" Fe3++2Br2+6Cl-
③电解精炼铜时,以粗铜作阴极,纯铜作阳极
④钢铁的吸氧腐蚀负极电极反应式:Fe-3e-=Fe3+
⑤碳酸氢根离子的电离方程式可表示为: HCO3- + H2O H3O++ CO32-
H3O++ CO32-
⑥SiO2虽是酸性氧化物,但其不溶于水,因此不能与NaOH溶液反应
⑦ CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在
⑧浓硫酸具有脱水性,所以可以做干燥剂
| A.②④⑧ | B.②⑤ | C.③④⑥ | D.④⑤ |
A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为 。
(2)B2 A和X的分子结合质子的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为 ,Q为 (填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式 。
(6)已知工业合成X的反应方程式:D2 (g)+3B2 (g)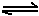 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
| A.碳酸氢钙溶液中加入过量的氢氧化钠溶液的离子方程式:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | ||
| B.使pH试纸显红色的溶液中,Fe2+、K+、NO3-、Cl-不可能大量共存 | ||
| C.铁在较强酸性环境中发生电化腐蚀的正极反应方程式是:2H2O+O2+4e-=4OH- | ||
D.标况下,将盛满HCl气体的烧瓶倒立在盛有足量水的水槽中,足够时间后烧瓶中所得溶液的物质的量浓度为
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com