
题目列表(包括答案和解析)
已知HClO ![]() H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。

(1)通入干燥的氯气后,集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有很快褪色,由此甲同学认为:干燥的氯气 漂白性,潮湿的氯气 漂白性(填“有”或“没有”)。
(2)细心的乙同学发现,一段时间后干燥的有色布条也褪色了。他经过仔细思考,认为甲的设计有缺陷,应该作如下修改: 。
(3)烧杯中NaOH溶液所起的作用是 ,
烧杯中所发生反应的化学方程式为 。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时5分钟,小烧杯中盛2 mol·L—1的NaOH溶液的体积至少应为 mL。
(5)丙同学按照乙同学的方案修改后,补做了盐酸加入到有色布条,发现有色布条不褪色。丙同学确认是HClO使有色布条褪色,但丁同学认为还是不能确认HClO使湿润的有色布条褪色,他认为还应增加的实验是: 。
已知HClO H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
(1)通入干燥的氯气后,集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有很快褪色,由此甲同学认为:干燥的氯气 漂白性,潮湿的氯气 漂白性(填“有”或“没有”)。
(2)细心的乙同学发现,一段时间后干燥的有色布条也褪色了。他经过仔细思考,认为甲的设计有缺陷,应该作如下修改: 。
(3)烧杯中NaOH溶液所起的作用是 ,
烧杯中所发生反应的化学方程式为 。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时5分钟,小烧杯中盛2 mol·L—1的NaOH溶液的体积至少应为 mL。
(5)丙同学按照乙同学的方案修改后,补做了盐酸加入到有色布条,发现有色布条不褪色。丙同学确认是HClO使有色布条褪色,但丁同学认为还是不能确认HClO使湿润的有色布条褪色,他认为还应增加的实验是: 。
已知HClO  H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
(1)通入干燥的氯气后,集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有很快褪色,由此甲同学认为:干燥的氯气 漂白性,潮湿的氯气 漂白性(填“有”或“没有”)。
(2)细心的乙同学发现,一段时间后干燥的有色布条也褪色了。他经过仔细思考,认为甲的设计有缺陷,应该作如下修改: 。
(3)烧杯中NaOH溶液所起的作用是 ,
烧杯中所发生反应的化学方程式为 。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时5分钟,小烧杯中盛2 mol·L—1的NaOH溶液的体积至少应为 mL。
(5)丙同学按照乙同学的方案修改后,补做了盐酸加入到有色布条,发现有色布条不褪色。丙同学确认是HClO使有色布条褪色,但丁同学认为还是不能确认HClO使湿润的有色布条褪色,他认为还应增加的实验是: 。
已知HClO  H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。

(1)通入干燥的氯气后,集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有很快褪色,由此甲同学认为:干燥的氯气 漂白性,潮湿的氯气 漂白性(填“有”或“没有”)。
(2)细心的乙同学发现,一段时间后干燥的有色布条也褪色了。他经过仔细思考,认为甲的设计有缺陷,应该作如下修改: 。
(3)烧杯中NaOH溶液所起的作用是 ,
烧杯中所发生反应的化学方程式为 。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时5分钟,小烧杯中盛2 mol·L—1的NaOH溶液的体积至少应为 mL。
(5)丙同学按照乙同学的方案修改后,补做了盐酸加入到有色布条,发现有色布条不褪色。丙同学确认是HClO使有色布条褪色,但丁同学认为还是不能确认HClO使湿润的有色布条褪色,他认为还应增加的实验是: 。
 H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。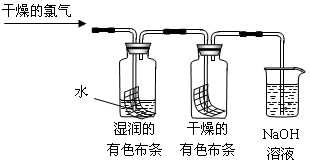
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com