
题目列表(包括答案和解析)

| β |
| 143.5 |
| β |
| 143.5 |
| 饮用矿物质水 净含量:500mL 配料表:纯净水 硫酸镁 氯化钾 保质期:12个月 主要离子成份:钾离子(K+):1.0~27.3mg/L 镁离子(Mg2+):0.1~4.8mg/L 氯离子( Cl-):10~27.3mg/L 硫酸根离子(SO42-):0.4~19.2mg/L 某溶液甲中可能含有下列离子中的几种:K+、NO3-、SO42-,、NH4+、CO32-(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验: 实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL; 实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g. (1)甲溶液中一定存在的离子是 K+、NH4+、S042- K+、NH4+、S042- ;(2)甲溶液中一定不存在的离子是 CO32- CO32- ;(3)甲溶液中可能存在的离子是 NO3- NO3- ;你得出此结论的理由是由题意知,NH4+物质的量为0.01mol,SO42-物质的量为0.01mol,根据溶液呈电中性原理,应该含有K+,如果K+的物质的量等于0.01mol,则不含NO3-,如果K+的物质的量大于0.01mol,则还应含有NO3-. 由题意知,NH4+物质的量为0.01mol,SO42-物质的量为0.01mol,根据溶液呈电中性原理,应该含有K+,如果K+的物质的量等于0.01mol,则不含NO3-,如果K+的物质的量大于0.01mol,则还应含有NO3-. .K3[Fe(C2O4)3]?3H2O(三草酸合铁酸钾晶体)是制备负载型活性铁催化剂的主要原料.实验室利用(NH4)2Fe(SO4)2?6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下: 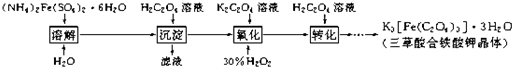 反应的原理为: 沉淀:(NH4)2Fe(SO4)2?6H2O+H2C2O4═FeC2O4?2H2O↓+(NH4)2SO4+H2SO4+4H2O 氧化:6FeC2O4+3H2O2+6K2C2O4═4K3[Fe(C2O4)3]+2Fe(OH)3 转化:2Fe(OH)3+3H2C2O4+3K2C2O4═2K3[Fe(C2O4)3]+6H2O (1)溶解的过程中要加入几滴稀硫酸,目的是 (2)沉淀过滤后,用蒸馏水洗涤,检验洗涤是否完全的方法是 (3)在沉淀中加入饱和K2C2O4溶液,并用40℃左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌.此过程需保持温度在40℃左右,可能的原因是 (4)为测定该晶体中铁的含量,某实验小组做了如下实验: 步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液. 步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根离子恰好全部氧化成二氧化碳.向反应后的溶液中加入足量锌粉,加热至黄色消失.然后过滤、洗涤,将滤液及洗涤液一并转入锥形瓶,此时溶液仍呈酸性. 步骤三:用标准KMnO4溶液滴定步骤二所得溶液至终点,记录消耗KMnO4溶液的体积(滴定中MnO4-被还原成Mn2+). 步骤四:…. 步骤五:计算,得出结论. 请回答下列问题: ①步骤一中需要用到的玻璃仪器有烧杯、量筒、玻璃棒、 ②步骤二中若加入KMnO4的量不足,则测得铁含量 ③写出步骤三中发生反应的离子方程式: ④请补充步骤四的操作: 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |