
题目列表(包括答案和解析)
MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
在反应中HCl既表现出酸性,又表现出还原性。试分析下列反应中酸的作用。
(1)Ba(OH)2+H2SO4===BaSO4↓+2H2O,H2SO4______________;
(2)C+2H2SO4(浓)![]() 2H2O+CO2↑+2SO2↑,H2SO4______________;
2H2O+CO2↑+2SO2↑,H2SO4______________;
(3)Cu+2H2SO4(浓)![]() 2H2O+CuSO4+SO2↑,H2SO4______________;
2H2O+CuSO4+SO2↑,H2SO4______________;
(4)2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑,HCl______________。
 MnCl2+Cl2↑+2H2O的叙述正确的是
MnCl2+Cl2↑+2H2O的叙述正确的是 下列微粒:Zn、Cl-、H+、Cl2、F2、Fe3+,在反应中能得到电子的是________,表现出________性,是________剂;具有还原性的微粒是________,它们在化学反应中________电子,化合价________,发生________反应.只具有氧化性的微粒是________,它的特征是________;只具有还原性的微粒是________,它的特征是________;既有氧化性又有还原性的微粒是________,它的特征是________.
(6分)铁及其化合物之间的相互转化可用下式表示:
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
a.Cl2 b.Fe c.HNO3 d.H2O2[来源:Zxxk.Com]
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为—2价),下列说法正确的是________(选填序号)。
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2 既作氧化剂又作还原剂
d.当转移1 mol电子时,46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(6分)铁及其化合物之间的相互转化可用下式表示:
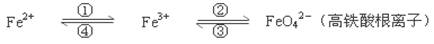
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
a.Cl2 b.Fe c.HNO3 d.H2O2[来源:Zxxk.Com]
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为—2价),下列说法正确的是________(选填序号)。
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2 既作氧化剂又作还原剂
d.当转移1 mol电子时,46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com