
(2010?厦门二模)某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填空:
【实验一】用如图所示装置,收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成.
(1)该反应的反应类型为
取代反应
取代反应
;
(2)该反应的化学方程式为
;(只写第一步)
(3)水槽中盛放的液体应为
C
C
;(填标号)
A.水 B.饱和石灰水
C.饱和食盐水D.饱和NaHCO,溶液
【实验二】收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO
3溶液,看到有白色沉淀生成,认为有氯化氢生成.
(4)该实验设计的错误之处
氯水中加入AgNO3溶液也会产生白色沉淀
氯水中加入AgNO3溶液也会产生白色沉淀
;
【实验三】
步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同).测得pH=3.26.
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在90W的日光灯下光照6min后,加入10mL蒸馏水,充分振荡,测得pH=1.00.
(5)判断该反应中有氯化氢生成的依据是
步骤二测得的pH值比步骤一测得的pH值低
步骤二测得的pH值比步骤一测得的pH值低
.
(6)假设氯气完全参与反应,且不考虑氯气溶解于水.往反应后的溶液中加水稀释到100.00mL,分别取20.00mL稀释液,以K
2CrO
7为指示剂,用浓度为0.01mol?L
-1的AgNO
3溶液滴定溶液中的Cl
-,滴定终点时消耗AgNO
3溶液的体积平均为10.00mL,则试管中原有氯气在标准状况下的体积为
11.2
11.2
mL;
步骤三:用5支试管充满甲烷和氯气的混合气体(各占50%),分别放在40W的日光灯下光照不同时间后,加入10mL蒸馏水,充分振荡,测得pH如下表:
| 编号 |
1 |
2 |
3 |
4 |
5 |
| 光照时间 |
2min |
4min |
6min |
8min |
10min |
| 反应后pH |
1.86 |
1.62 |
1.00 |
1.00 |
1.00 |
(7)该实验可得到结论:
相同条件下,一定时间内,甲烷与氯气反应的光照时间越长,甲烷取代反应的转化率越高或6分钟后甲烷与氯气的取代反应达到平衡
相同条件下,一定时间内,甲烷与氯气反应的光照时间越长,甲烷取代反应的转化率越高或6分钟后甲烷与氯气的取代反应达到平衡
;
步骤四:探究不同光照条件对甲烷与氯气反应速率的影响.
(8)试设计一个可行的实验方案:
用5支充满甲烷和氯气的混合气体(各占50%),分别放在不同功率的日光灯下光照相同时间后,加入l0mL蒸馏水,充分振荡,测pH
用5支充满甲烷和氯气的混合气体(各占50%),分别放在不同功率的日光灯下光照相同时间后,加入l0mL蒸馏水,充分振荡,测pH
.

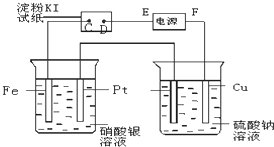 用图所示的装置进行电解.通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色.
用图所示的装置进行电解.通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色. (2010?厦门二模)某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填空:
(2010?厦门二模)某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填空: