
题目列表(包括答案和解析)
某学生用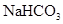 和
和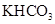 组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
|
|
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
|
2.24L |
3.36L |
3.36L |
则下列分析推理中不正确的是( )
A.盐酸的物质的量浓度为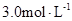
B.根据表中数据能计算出混合物中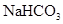 的质量分数
的质量分数
C.加入混合物9.2g的一组实验中盐酸过量
D.15.7g混合物恰好与盐酸完全反应
某学生用![]() 和
和![]() 组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
|
| 2.24L | 3.36L | 3.36L |
某学生用![]() 和
和![]() 组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
|
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 |
| m(混合物) | 9.2g | 15.7g | 27.6g |
|
| 2.24L | 3.36L | 3.36L |
则下列分析推理中不正确的是( )
A.盐酸的物质的量浓度为![]()
B.根据表中数据能计算出混合物中![]() 的质量分数
的质量分数
C.加入混合物9.2g的一组实验中盐酸过量
D.15.7g混合物恰好与盐酸完全反应
某学生用 和
和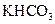 组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
组成的混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
| | 50mL盐酸 | 50mL盐酸 | 50mL盐酸 |
| m(混合物) | 9.2g | 15.7g | 27.6g |
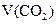 (标准状况) (标准状况) | 2.24L | 3.36L | 3.36L |
A.盐酸的物质的量浓度为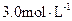 |
B.根据表中数据能计算出混合物中 的质量分数 的质量分数 |
| C.加入混合物9.2g的一组实验中盐酸过量 |
| D.15.7g混合物恰好与盐酸完全反应 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com