
题目列表(包括答案和解析)

| 放电 |
| 充电 |
| ||
| ||
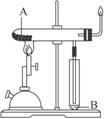
煤是由________和________组成的复杂混合物.直接燃烧可以产生大量的污染物,如碳的氧化物、氮的氧化物、硫的氧化物、烟尘碳粒,还有挥发出来的碳氢化合物等,其中能够使雨水酸化的有毒气体是________和________.对煤综合利用可以获得洁净的燃料和多种化工产品,煤的综合利用方法很多,其中如图所示,将煤隔绝空气加强热使之分解的方法叫________,该过程可以产生液体B________,还生成可燃性的气体,这些可燃性的气体有________(最少写出3种);从B中能够分离提取出一种片状晶体——萘,其结构简式是:![]() ,其分子式是________.
,其分子式是________.

(15)分水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:

相关信息如下:
①[Cu(NH3)4]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++![]() +H2O
+H2O
![]()
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇·水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下:

请根据以下信息回答下列问题:
(1)方案1的实验步骤为:
a. 加热蒸发 b. 冷却结晶 c. 抽滤 d. 洗涤 e. 干燥
①步骤1的抽滤装置如下图所示,该装置中的错误之处是 ;抽滤完毕或中途停止抽滤时,应先 ,然后 。

②该方案存在明显缺陷,因为得到的产物晶体事往往含有 杂质,产生该杂质的原因是 。
(2)方案2的实验步骤为:
a. 向溶液C加入适量 ,b. ,c. 洗涤,d. 干燥
①请在上述内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是 。
A. 乙醇 B. 蒸馏水 C. 乙醇和水的混合液 D. 饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是 。

| | 开始沉淀的pH | 沉淀完全的pH | 沉淀溶解的pH |
| Cu2+ | 4.4 | 6.4 | |
| Al3+ | 3.0 | 5.0 | 10 |
| Zn2+ | 5.9 | 8.9 | 11 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com