
电化学在工业生产中有广泛应用.
(一)如图1所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.
(1)若试管内液面上升,发生
吸氧
吸氧
腐蚀,电极反应为负极:
Fe-2e-+2OH-═Fe(OH)2
Fe-2e-+2OH-═Fe(OH)2
;正极:
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.
(2)若试管内液面下降,则烧杯中的溶液呈
强酸
强酸
性,正极的电极反应为:
2H++2e-═H2↑
2H++2e-═H2↑
.
(二)如图2为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
(1)写出甲电解池中的电解总反应方程式:
2CuSO4+2H2O═2Cu+O2↑+2H2SO4
2CuSO4+2H2O═2Cu+O2↑+2H2SO4
.
(2)若甲槽阴极增重12.8g,则乙槽阳极放出气体为
Cl2
Cl2
,在标准状况下的体积为
4.48L
4.48L
;检验该气体一般用湿润的淀粉-KI试纸,现象是
试纸变蓝
试纸变蓝
,发生的反应是
Cl2+2I-═I2+2Cl-
Cl2+2I-═I2+2Cl-
.
(3)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
1mol/L
1mol/L
;电解过程中,乙槽溶液pH的变化为(“升高”、“降低”或“不变”)
升高
升高
.

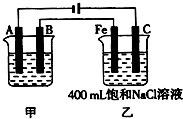 图为相互串联的甲、乙两电解池.试回答:
图为相互串联的甲、乙两电解池.试回答: 电化学在工业生产中有广泛应用.
电化学在工业生产中有广泛应用.