
题目列表(包括答案和解析)
比较氯化钠和氯化氢的形成过程,总结其区别与联系。
__________________________________________________________________


比较氯化钠和氯化氢的形成过程,总结其区别与联系.



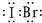
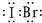


现有A、B、C、D、E五种元素,它们的质子数依次增多.
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2∶1.试回答:
(1)A、B、C、D、E各是什么元素(写元素名称及元素在周期表中的位置):
A________、B________、C________、D________、E________.
(2)A的原子结构示意图________,B的离子结构示意图________,D的单质分子的电子式________,C元素最高价氧化物的水化物的电子式________用电子式表示H2A的形成过程________
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:________,________
(4)比较B、C、E三种元素形成的简单离子其离子半径的大小和氧化性的强弱:(B、C、E离子用实际离子符号表示)
离子半径:________;氧化性:________.
(5)写出E与冷水反应的离子方程式:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com