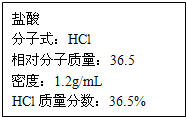
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为
12
12
mol/L.
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
BD
BD
.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl
-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.3mol/L稀盐酸.
①该学生需要量取
12.5
12.5
mL上述浓盐酸进行配制.
②配制过程中,需要使用的仪器是(填写代号)
ABFGH
ABFGH
.
A.烧杯 B.量筒 C.1000mL容量瓶 D.托盘天平
E.药匙 F.500mL容量瓶 G.胶头滴管 H.玻璃棒
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
BCAFED
BCAFED
;
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
④在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是
BCD
BCD
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为
mol/L.
(5)现将100mL0.5mol/L的盐酸200mL0.1mol/LCuCl
2溶液混合,体积变化忽略不计,所得溶液中Cl
-的物质的量浓度是
0.3mol/L
0.3mol/L
.


 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:

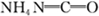
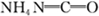
 (2011?天津模拟)燃煤废气中的氮氧化物(NOX)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
(2011?天津模拟)燃煤废气中的氮氧化物(NOX)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.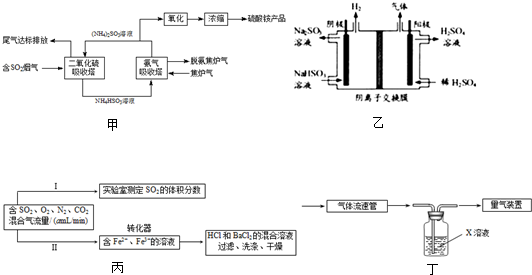
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
