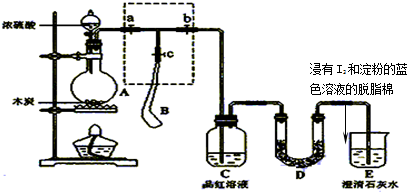
(2011?南京模拟)为检验浓硫酸与木炭在加热条件下反应产生的SO
2和CO
2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I
2和淀粉的蓝色溶液浸湿的脱脂棉,浸有I2和淀粉的蓝色溶液的脱脂棉,
请回答下列问题:
(1)装置A、D中发生反应的化学方程式为
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
;
I2+SO2+2H2O=H2SO4+2HI
I2+SO2+2H2O=H2SO4+2HI
.
(2)实验前欲检查装置A的气密性,可以采取的操作是
关闭分液漏斗的活塞,打开止水夹a和b,关闭止水夹c,用手捂热(或微热)圆底烧瓶A,若C中有气泡冒出,移开手掌(或热源)后,C处导管内有水上升,则证明A装置的气密性良好
关闭分液漏斗的活塞,打开止水夹a和b,关闭止水夹c,用手捂热(或微热)圆底烧瓶A,若C中有气泡冒出,移开手掌(或热源)后,C处导管内有水上升,则证明A装置的气密性良好
;
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是
③①②
③①②
(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为
品红溶液褪色
品红溶液褪色
;
(5)当D中产生
进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
现象时,可以说明使E中澄清石灰水变浑浊的是CO
2,而不是SO
2;
(6)装置D的作用为
除去SO2并检验SO2已被除净
除去SO2并检验SO2已被除净
.

 某学生为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如图所示的实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.请回答下列问题:
某学生为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如图所示的实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.请回答下列问题: