
题目列表(包括答案和解析)
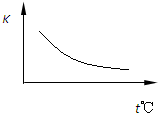 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ?mol-1.已知该反应的平衡常数K与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ?mol-1.已知该反应的平衡常数K与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:| Kt℃ 时间/min |
CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
工业上制备H2的一种重要方法是:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
|
| CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q 0(填“>”、“=”或“<”)。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
(4)上表中c2为 mol·L=1,CO(g)的转化率为 。
工业上制备H2的一种重要方法是:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=Q kJ?mol1
CO2(g)+H2(g) △H=Q kJ?mol1
已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L1)随时间的变化关系如下表:

| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q 0(填“>”、“=”或“<”=。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
(4)上表中c2为 mol?L=1,CO(g)的转化率为 。
(12分)背景资料:锌是人体中必需的14种微量元素之一,它不但具有重要的生物功能:影响生长发育,改善食欲及消化机能,加速创伤组织的愈合和再生,增强机体免疫功能,参与肝脏及视网膜内维生素A的代谢,保证生殖机能的正常发育,保证胆固醇与高密度脂蛋白的代谢,影响人和动物的行动和情绪,与智力发育密切相关,可防治感冒,与癌症有关,而且与人体中不下200种金属酶有关,参与多种酶的合成与组成,在核酸、蛋白质、糖、脂质代谢及RNA、DNA的合成中发挥着重要作用,与肌体的代谢及某些疾病的发生关系极为密切。因此,锌添加剂的研究一直被人们重视。无机锌盐,如ZnCO3、ZnSO4?7H2O、ZnCl2、ZnAc2等作为最早采用的补锌剂,但是由于它们易吸潮、生物吸收率低、口感不适,对胃肠道具有较大的刺激作用,个别盐甚至会引起胃出血,因而逐渐被淘汰。
1.用有机弱酸作配体,比无机锌盐有较好的吸收,但由于其合成复杂,收率低,且含锌较低,不适宜于糖尿病人的补锌,它们也不是最理想的补锌剂。用的有机弱酸锌如甘草酸锌和葡萄糖酸锌等。葡萄糖酸锌常以葡萄糖酸钙、浓H2SO4、ZnO等为原料合成,请写出反应方程式 ;另外一种有机弱酸配体,请写出结构简式 。
2.氨基酸作为蛋白质的基本结构单元,在人体中有非常重要的生理作用。氨基酸锌是含有二价锌阳离子的螯合状化合物,该环一般是几元环 ;正是由于该结构特点,结构决定性质,所以可以预测氨基酸锌的典型优点 (意思正确即可);制备氨基酸锌的一种新方法是电解合成法,该法是利用一种可选择阳离子而不渗透阴离子的特殊膜,将电解池分成阳极室和阴极室,氨基酸(RCH(NH2)COOH)作为电解液的主要成分。
(1)如果阳极是由纯金属锌构成,那么在阳极室就可以形成螯合物,阳极反应可以表示为 ; 。阴极的电极反应为 。
(2)氯化锌被加到阳极室,发现阴极、阳极都有气体放出,请写出电极反应为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com