高铁酸钾的确是一种新型、高效、多功能水处理剂,应用前景广阔.实验室以次氯酸盐和铁盐为原料制备少量高铁酸钾的操作步骤如下:
(1)制备次氯酸钾强碱性饱和溶液:①在100mL水中溶解56gKOH,冷至室温后倒入三口瓶中(装置见右图),
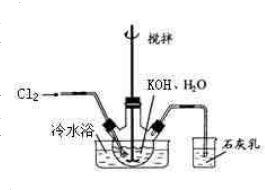
冷水浴冷却,通入Cl
2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
①石灰乳的作用是
除去未反应氯气,防止氯气污染空气
除去未反应氯气,防止氯气污染空气
.石灰乳参与反应的化学方程式
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
.
②反应过程中和保存饱和次氯酸钾中用冷水浴冷却的原因是
温度高时,反应生成氯酸钾,6KOH+3Cl
2
5KCl+KClO
3+3H
2O,
温度高时,反应生成氯酸钾,6KOH+3Cl
2
5KCl+KClO
3+3H
2O,
降低了次氯酸钾的产量
降低了次氯酸钾的产量
(以必要文字和方程式加以说明).
③在上述制备过程中不断搅拌原因是
反应放热,不利于次氯酸钾的生成.
反应放热,不利于次氯酸钾的生成.
(以必要文字加以说明).
(2)合成高铁酸钾:将次氯酸钾饱和溶液转入烧杯,冷水浴冷却,在剧烈搅拌下分次加入13.5g研细的FeCl
3?6H
2O,立即产生大量紫黑色K
2FeO
4.加少量稳定剂Na
2SiO
3?9H
2O和CuCl
2?2H
2O,反应30min后,分次加入100gKOH固体,保持温度在20℃以下,陈化30min,用玻璃砂芯漏斗抽滤,得高铁酸钾粗品.
①写出合成高铁酸钾的离子方程式
Fe3++3OH-=Fe(OH)3,2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
Fe3++3OH-=Fe(OH)3,2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
.
②13.53gFeCl
3?6H
2O理论上可制得高铁酸钾
9.9
9.9
g.
(3)高铁酸钾的净水原理:①高铁酸钾在水中发生反应生成Fe(OH)
3胶体.写出化学方程式
4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2
4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2
删除此空
删除此空
.②高铁酸钾作为水处理剂发挥的作用是
消毒
消毒
、
净水
净水
.

 冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液. 5KCl+KClO3+3H2O,
5KCl+KClO3+3H2O, 5KCl+KClO3+3H2O,
5KCl+KClO3+3H2O,