
题目列表(包括答案和解析)
解:设样品中碳酸氢钠的质量为x, 生成氯化钠的质量为y
![]() NaHCO3 + HCl NaCl + CO2↑+ H2O(1分)
NaHCO3 + HCl NaCl + CO2↑+ H2O(1分)
84 58.5 44
x y 4.4 g
 |
== x = 8.4 g(1分)
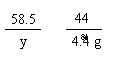 |
== y = 5.85 g(1分)
|
![]()
|
(2) 恰好完全反应时,所得溶液中溶质的质量分数为:
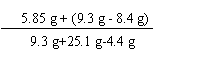 |
╳100% = 22.5%(2分)
 碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.| 实验 | 实验现象 | 结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入氯化钙溶液 | 产生白色沉淀 产生白色沉淀 |
固体产物是Na2CO3,而不是NaOH |
| 实验三: 取少量反应后的固体产物溶于水,加入稀盐酸(或稀硫酸) 取少量反应后的固体产物溶于水,加入稀盐酸(或稀硫酸) |
产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
| ||
| ||
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2(2Na2CO3?3H2O2)=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解;I、制备研究:图1是制备过碳酸钠的工艺流程. 请回答问题: (1)操作A的名称是 过滤. 过滤. ,若在实验室完成此操作,需要的玻璃仪器是烧杯、漏斗 漏斗 和玻璃棒 玻璃棒 .(2)生产中,反应及干燥均需在较低温度下进行,原因是 防止过碳酸钠分解,影响产量和产率 防止过碳酸钠分解,影响产量和产率 .Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数. 小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验. 【实验步骤】: ①连接仪器,检查装置的气密性; ②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水; ③连接仪器,打开分液漏斗活塞,缓缓滴入水; ④待装置A中不再产生气泡时,停止加水,并关闭活塞; ⑤待量筒中水面不再变化时,记录其中水面刻度; ⑥根据数据进行计算. 【实验分析积数据处理】: (3)实验中, A A ,则开始收集气体.A.刚开始出现气泡时 B.当气泡均匀连续出现时 C.若用带火星木条放在导管口部,复燃时 (4)若量筒中收集到气体的体积是224mL(换算后质量约为0.32g),计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数 95.0% 95.0% .[Mr(2Na2CO3?3H2O2)=314,保留到0.1%】【实验反思】: (5)经过讨论,小组同学一致认为测定结果偏大,可能原因是 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 .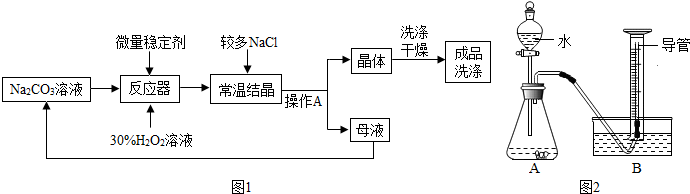
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究。
【讨论与评价】实验一的结论与实验二、实验三的结论相反,在讨论时兴趣小组的同学认为方案一的结论不正确,他们的理由是_____________________________________________。 【总结】请写出碳酸氢钠受热分解的化学方程式________________________。 (4)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质),取样品10.0 g逐滴加入稀盐酸,所得气体的质量为4.4 g。求:样品中碳酸氢钠的质量分数。 碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究。 【查阅资料】 Ⅰ.碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。 Ⅱ.碳酸钠溶液呈碱性。 【进行实验】为了验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示。
(1)加热一段时间后,观察到烧杯内壁有__________。 (2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊。写出该反应的化学方程式:___________________。 (3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3。 ①他们的依据是____________________________________。 ②兴趣小组为了确定反应后的固体产物成分进行以下实验,请填写下表:
【讨论与评价】实验一的结论与实验二、实验三的结论相反,在讨论时兴趣小组的同学认为方案一的结论不正确,他们的理由是_____________________________________________。 【总结】请写出碳酸氢钠受热分解的化学方程式________________________。 (4)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质),取样品10.0 g逐滴加入稀盐酸,所得气体的质量为4.4 g。求:样品中碳酸氢钠的质量分数。
同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |