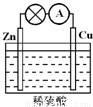
某学生利用如图1所示实验装置探究盐桥式原电池的工作原理.
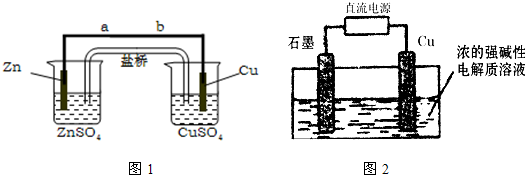
按照实验步骤依次回答下列问题:
(1)导线中电子流向为
由a到b(或a→b)
由a到b(或a→b)
(用a、b 表示).
(2)写出装置中锌电极上的电极反应式:
Zn-2e-=Zn2+
Zn-2e-=Zn2+
;
(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为
1.204×1022
1.204×1022
;
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K
+、Cl
-的移动方向表述正确的是
B
B
.
A.盐桥中的K
+向左侧烧杯移动、Cl
-向右侧烧杯移动
B.盐桥中的K
+向右侧烧杯移动、Cl
-向左侧烧杯移动
C.盐桥中的K
+、Cl
-都向右侧烧杯移动
D.盐桥中的K
+、Cl
-几乎都不移动
(5)若ZnSO
4溶液中含有杂质Cu
2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减.欲除去Cu
2+,最好选用下列试剂中的
B
B
(填代号).
A.NaOH B.Zn C.Fe D.H
2SO
4(6)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的
吸氧
吸氧
腐蚀.为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的
负
负
极(填“正”或“负”)相连.钢铁在呈中性的潮湿环境下的腐蚀比呈酸性时缓慢,在碱性潮湿环境下的腐蚀更缓慢,试从化学平衡角度解释碱性时比中性时更缓慢原因
O2+4e-+2H2O=4OH-碱性较强时,OH-浓度较大,根据平衡移动原理,抑制了上述电极反应的发生,所以腐蚀缓慢
O2+4e-+2H2O=4OH-碱性较强时,OH-浓度较大,根据平衡移动原理,抑制了上述电极反应的发生,所以腐蚀缓慢
(写出电极反应式及必要的文字叙述).
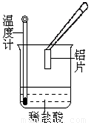
(7)Cu
2O是一种半导体材料,可通过如图2所示的电解装置制取,电解总反应为:2Cu+H
2O
Cu
2O+H
2,阴极的电极反应式是
2H++2e-=H2
2H++2e-=H2
.若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H
+被消耗时,Cu
2O的理论产量为
7.2
7.2
g.


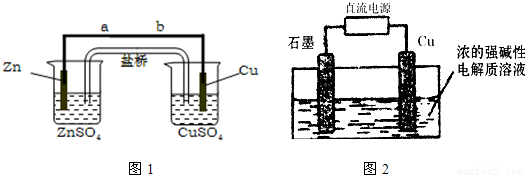
 Cu2O+H2,阴极的电极反应式是______.若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为______g.
Cu2O+H2,阴极的电极反应式是______.若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为______g.
 能源是现代社会发展的支柱之一,化学能是重要的能源.
能源是现代社会发展的支柱之一,化学能是重要的能源.