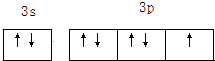
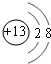
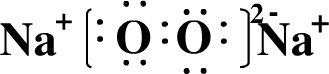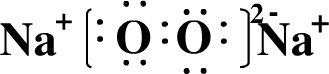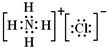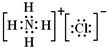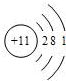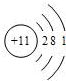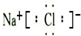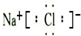A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4.1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子.试回答:
(1)A是
Na
Na
元素,B是
Al
Al
元素,C是
Cl
Cl
元素.
(2)写出A元素的单质在氧气燃烧时生成物的电子式:
.
(3)写出由A元素和C元素组成化合物的形成过程:
.
(4)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:
OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O
OH-+H+═H2O、Al(OH)3+3H+═Al3++3H2O
.
(5)A离子的氧化性比B离子的氧化性
弱
弱
,这是由于
A单质的还原性强或A元素的金属性强
A单质的还原性强或A元素的金属性强
.