
题目列表(包括答案和解析)
 2SO3,下列说法错误的是( )
2SO3,下列说法错误的是( )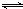 2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则氧气在反应起始时的浓度可能是( )
2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则氧气在反应起始时的浓度可能是( )
 H2CO3+OH-
H2CO3+OH- H2CO3+OH-
H2CO3+OH- 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com