
题目列表(包括答案和解析)
如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为
(2)B中Sn极的电极反应式为 Fe Sn Fe Zn Fe
Sn极附近溶液的PH值 (填“变大”、“变小”、“不变”)
(3)C中被腐蚀的金属是 ,总反应式为
,比较A、B、C中铁被腐蚀的速率,
由快到慢的顺序为 。 A B C
(12分)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:
(1)A中反应的离子方程式是 。
(2)B中Sn极的电极反应式为____________________,Sn极附近溶液的pH__________(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是__________,总反应离子方程式是____________________,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________。
(12分)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示: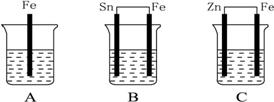
(1)A中反应的离子方程式是 。
(2)B中Sn极的电极反应式为____________________,Sn极附近溶液的pH__________(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是__________,总反应离子方程式是____________________,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________。
(12分)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:

(1)A中反应的离子方程式是 。
(2)B中Sn极的电极反应式为____________________,Sn极附近溶液的pH__________(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是__________,总反应离子方程式是____________________,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com