
题目列表(包括答案和解析)
 把在空气中久置的铝片5.0g投入盛有500mL0,5mol?L-1盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL0,5mol?L-1盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题: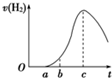 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示. (2011?鹰潭二模)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
(2011?鹰潭二模)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )把在空气中久置的铝片5.0 g投入盛有 500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示:
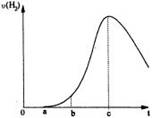 下列推论错误的是
下列推论错误的是
A.t由0→a段不产生氢气是因为铝的表面存在一层致密的
氧化膜
B.t由b→c段产生氢气的速率增加较快的主要原因之一是
温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低
把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题: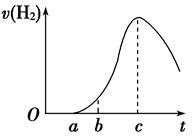
(1)曲线由O →a段不产生氢气的原因是___________________________________
有关反应的化学方程式为_________________________________
(2)曲线a→c段,产生氢气的速率增加较快的主要原因是_________________________
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________
(4)该反应若使用催化剂,可使H2产量增多吗______________(填“会”或“不会”)。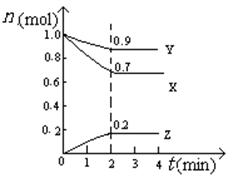
(5)某温度时,在2L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
由图中的数据分析,该反应的化学方程式为 。
反应从开始至2min末,Z的平均反应速率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com