
题目列表(包括答案和解析)
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
|
n(SO3²﹣):n(HSO3﹣) |
91 :9 |
1 :1 |
1 :91 |
|
pH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,从原理的角度解释原因
②在NaHSO3溶液中离子浓度关系不正确的是(选填字母):
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)= 2 c(SO32-)+ c(HSO3-)+ c(OH-)
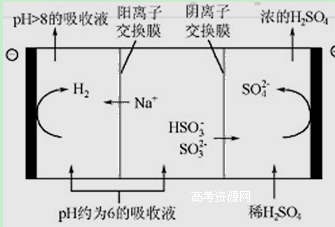
(4)当吸收液的pH降至约为6时,需送至电解槽再生 。再生示意图如下:

① 吸收液再生过程中的总反应方程式是 。
② 当电极上有1mol电子转移时阴极产物为 克.
(7分) 科学家一直致力于“人工固氮”的方法研究。
⑴目前合成氨的技术原理为:
该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。

⑶根据最新“人工固氮”的研究报道,在常温、常 压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:

进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①合成反应的a_ 0。(填“大于”、“小于”或“等于”)
②已知

则
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
(13分)
(1)稀有气体不能形成双原子分子是因为 。
(2)多电子原子中,在离核较近的区域内运动的电子能量 (填较高或较低)。
(3)不含中子的核素的核组成符号为 。
(4)ⅥA族氢化物中沸点最低的是 (写化学式)。
(5)在金属元素与非金属元素的分界线附近可以寻找制备 材料的元素;在
中可寻找制备催化剂及耐高温、耐腐蚀的元素。
(6)下列选项中,随原子序数递增而呈周期性变化的是 (填序号,后同);其中,起决定性作用的是
A.原子核外电子排布,B.原子半径,C.主要化合价,D.元素的金属性或非金属性。
(7)下列核素中,用于考古时测文物年代的是 (填序号)。
A.2H和3H, B.14C, C.235U。
(8)下列实验中,可产生白烟的是 (填序号)。
A.氢气与氯气反应,B钠与氯气反应。
(9)下列反应中,更剧烈的是 (填序号)。
A.钠与水反应,B.钾与水反应。
(10)取下列溶液分装两试管,再分别依次加入少量氯水和少量四氯化碳,用力振荡、静置后,四氯化碳层显橙红色的是 (填序号)。
A.溴化钠溶液,B.碘化钾溶液。
(11)用电子式表示MgCl2的形成过程 。
(13分)
(1)稀有气体不能形成双原子分子是因为 。
(2)多电子原子中,在离核较近的区域内运动的电子能量 (填较高或较低)。
(3)不含中子的核素的核组成符号为 。
(4)ⅥA族氢化物中沸点最低的是 (写化学式)。
(5)在金属元素与非金属元素的分界线附近可以寻找制备 材料的元素;在
中可寻找制备催化剂及耐高温、耐腐蚀的元素。
(6)下列选项中,随原子序数递增而呈周期性变化的是 (填序号,后同);其中,起决定性作用的是
A.原子核外电子排布,B.原子半径,C.主要化合价,D.元素的金属性或非金属性。
(7)下列核素中,用于考古时测文物年代的是 (填序号)。
A.2H和3H, B.14C, C.235U。
(8)下列实验中,可产生白烟的是 (填序号)。
A.氢气与氯气反应,B钠与氯气反应。
(9)下列反应中,更剧烈的是 (填序号)。
A.钠与水反应,B.钾与水反应。
(10)取下列溶液分装两试管,再分别依次加入少量氯水和少量四氯化碳,用力振荡、静置后,四氯化碳层显橙红色的是 (填序号)。
A.溴化钠溶液,B.碘化钾溶液。
(11)用电子式表示MgCl2的形成过程 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com