
题目列表(包括答案和解析)
(10分)江苏省拥有丰富的海洋资源,盐化工是连云港市的主要产业之一。从盐卤初步得到的光卤石(KCl?MgCl2?6H2O)晶体中,还含有约8%的NaCl。
![]() 为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
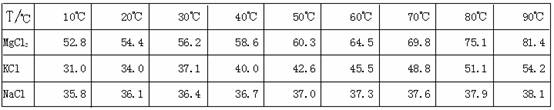 |
![]()
![]()
![]()
![]()
![]()
并设计出下面的实验流程:w.w.w.k.s.5.u.c.o.m
![]()

![]()
![]()
![]()
![]()
根据他们提供的数据和实验回答下列问题:
![]() 问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
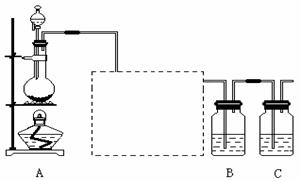
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2?6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。
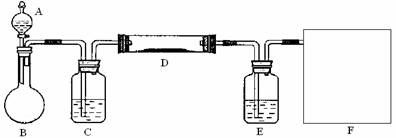
问题3:MgO则是重要的耐火材料。在550℃时,MgCl2?6H2O会分解生成MgO、MgCl2、HCl和水,若不补充其它原料,使一定量的MgCl2?6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则 a∶b≈_______(取整数值)。
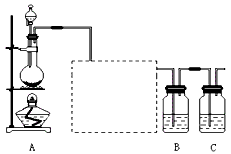
探究一:该小组制备溴乙烷的主要步骤如下:?
①向装置图所示的U形管和大烧杯中加入冷水;?
②在小烧杯中按一定比例配制乙醇、水、浓硫酸混合液;?
③向装置图所示的圆底烧瓶中加入一定量研细的溴化钠和少量碎瓷片;?
④将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤精制溴乙烷。?
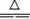
回答下列问题:?
(1)步骤②向乙醇和水缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是___________________。?
(2)步骤④加热片刻后,烧瓶内的混合物会出现橘红色,出现这种现象的原因是(请用化学方程式表示)_____________________________,改用小火加热后,橘红颜色会逐渐消去,消失的原因是(请用化学方程式表示)__________________________________。?
(3)为了更好地控制反应温度,除按图示小火加热,还可采用的加热方式是________________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,弃去(填“上层”或“下层”)_________液体。为了除去粗产品中的杂质,可用下列试剂中的________(填序号)。
A.氢氧化钠稀溶液
B.碳酸钠稀溶液?
C.硝酸银溶液
D.四氯化碳?
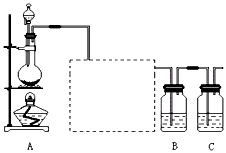
探究二:溴乙烷与NaOH乙醇溶液的反应?
学习小组在进行溴乙烷与NaOH乙醇溶液的反应中,观察到有气体生成。?
请你设计两种不同的方法分别检验该气体,并使用下列简易图标,在答题卡的方框中画出这两种方法的实验装置示意图(所给各种图标,使用次数不限,也可以不全部用),并写出装置中所盛试剂的名称(试剂任选)和实验现象。?
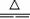
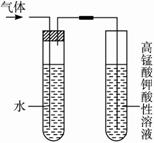
已知非金属单质硫(S)是淡黄
色固体粉末,难溶于水。为了验
 证氯元素的非金属性比硫元素的
证氯元素的非金属性比硫元素的
非金属性强,某化学实验小组设
计了如下实验,请回答下列问题:
(1) 装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是 。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用 。
(3) 装置B中盛放的试剂是 (此空选填下列所给试剂的代码),实验现象为 ,化学反应方程式是 , 该反应属于四种基本反应类型中的 反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4) 还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。 。
(5) 装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com